题目内容
下列离子方程式中正确的是 ( )
| A.将SO2气体通入NaCIO溶液中:SO2+2ClO—+H2O=SO32-+2HCIO | |
| B.向FeBr2溶液中通入过量Cl2:2Fe2++4Br—+2Cl2=2Fe3++2Br2+4Cl— | |
| C.向硫酸氢钾溶液中加入Ba(OH)2溶液至中性:2H++SO42—+Ba2++2OH—=BaSO4↓+2H2O高考 | D.NH4HCO3溶液与过量NaOH溶液反应:NH4++OH—=NH3↑+H2O |
C
略

练习册系列答案
相关题目
 答下列问题。
答下列问题。 种盐溶解于水制得,则该盐的化学式为 。
种盐溶解于水制得,则该盐的化学式为 。 
 同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入与H2SO4溶液同浓度的Ba(OH)2溶液至恰好完全反应。试回答下列问题:
同时有一表面光滑的塑料小球悬浮于溶液中央,向该烧杯中缓缓注入与H2SO4溶液同浓度的Ba(OH)2溶液至恰好完全反应。试回答下列问题:
 、Mg2+、Fe3+、Al3+、
、Mg2+、Fe3+、Al3+、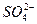 等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是_____________,且各阳离子的物质的量之比为_____________;肯定不含有的阳离子是_____________;检验可能含有的某种阳离子的实验方法是____________________________________________________。
等离子,当向该溶液中加入某浓度的NaOH溶液时,发现生成沉淀的物质的量随NaOH溶液的体积变化如图所示,由此可知,该溶液中肯定含有的阳离子是_____________,且各阳离子的物质的量之比为_____________;肯定不含有的阳离子是_____________;检验可能含有的某种阳离子的实验方法是____________________________________________________。