题目内容
(2012?广州一模)短周期元素甲、乙、丙、丁的原子序数依次增大,甲位于第VA族,乙原子的核外电子数比甲原子多1,乙与丁同族,丙原子最外层电子数与电子层数相等,则( )
分析:短周期元素甲、乙、丙、丁的原子序数依次增大,甲位于第VA族,乙原子的核外电子数比甲原子多1,应位于第ⅥA族,乙与丁同族,则乙为O元素,丁为S元素,丙原子最外层电子数与电子层数相等,应为Al元素,则甲为N元素,结合元素周期律解答该题.
解答:解:短周期元素甲、乙、丙、丁的原子序数依次增大,甲位于第VA族,乙原子的核外电子数比甲原子多1,应位于第ⅥA族,乙与丁同族,则乙为O元素,丁为S元素,丙原子最外层电子数与电子层数相等,应为Al元素,则甲为N元素,则
A.同周期元素从左到右原子半径逐渐减小,则原子半径Al>S,同主族元素从上到下原子半径逐渐减小,则原子半径S>O,则有Al>S>O,即丙>丁>乙,故A正确;
B.甲的气态氢化物为NH3,溶液呈碱性,故B错误;
C.丙与乙形成的化合物为Al2O3,为两性氧化物,故C正确;
D.丁为S元素,位于周期表第三周期,酸性最强的应为HClO4,故D错误.
故选AC.
A.同周期元素从左到右原子半径逐渐减小,则原子半径Al>S,同主族元素从上到下原子半径逐渐减小,则原子半径S>O,则有Al>S>O,即丙>丁>乙,故A正确;
B.甲的气态氢化物为NH3,溶液呈碱性,故B错误;
C.丙与乙形成的化合物为Al2O3,为两性氧化物,故C正确;
D.丁为S元素,位于周期表第三周期,酸性最强的应为HClO4,故D错误.
故选AC.
点评:本题考查原子结构和元素周期律的关系,题目难度不大,学习中注意元素周期律的递变规律,把握从原子结构的角度如何推断元素的种类.

练习册系列答案
相关题目
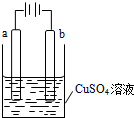 (2012?广州一模)某小组为研究电化学原理,设计如图装置,下列叙述正确的是( )
(2012?广州一模)某小组为研究电化学原理,设计如图装置,下列叙述正确的是( )