题目内容
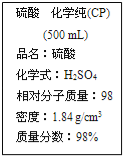
【题目】已知H2CO3、CH3COOH和HCOOH的电离常数分别为4.3×10-7(Ka1)、1.8×10-5、1.7×10-4。等体积、浓度均为0.1 mol·L-1的三种溶液:①CH3COOH溶液 ②HCOOH溶液 ③NaHCO3溶液,将①、②分别与③混合。下列说法正确的是( )
A.相同浓度的甲酸、乙酸和碳酸中酸性最强的是CH3COOH
B.实验测得产生的CO2气体体积(V)随时间(t)变化的曲线如图所示

C.上述三种溶液中由水电离的c(OH-)大小:NaHCO3>CH3COOH>HCOOH
D.①与③混合后所得溶液中:c(CH3COO-)+c(CH3COOH)=0.10 mol·L-1
【答案】C
【解析】根据给出的电离常数可知酸性最强的是HCOOH,A项错误;由给出的电离常数可知,HCOOH的酸性比CH3COOH强,相同浓度时,HCOOH溶液中H+浓度大,故甲酸与碳酸氢钠反应的速率比乙酸与碳酸氢钠反应的速率快,B项错误;HCO![]() 的水解程度大于其电离程度,故NaHCO3促进水的电离,酸电离出氢离子,抑制水的电离,因酸性:CH3COOH<HCOOH,故后者抑制水电离的程度更大,因此题中的三种溶液中由水电离的c(OH-)大小:NaHCO3>CH3COOH>HCOOH,C项正确;等体积、浓度均为0.1 mol·L-1的CH3COOH溶液和NaHCO3溶液混合后,溶液体积加倍,故c(CH3COO-)+c(CH3COOH)=0.050 mol·L-1,D项错误。
的水解程度大于其电离程度,故NaHCO3促进水的电离,酸电离出氢离子,抑制水的电离,因酸性:CH3COOH<HCOOH,故后者抑制水电离的程度更大,因此题中的三种溶液中由水电离的c(OH-)大小:NaHCO3>CH3COOH>HCOOH,C项正确;等体积、浓度均为0.1 mol·L-1的CH3COOH溶液和NaHCO3溶液混合后,溶液体积加倍,故c(CH3COO-)+c(CH3COOH)=0.050 mol·L-1,D项错误。

练习册系列答案
 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案
相关题目