题目内容
下列关于Na2CO3和NaHCO3的性质比较中,不正确的是
| A.热稳定性: Na2CO3 > NaHCO3 |
| B.常温时在水中的溶解度:Na2CO3 > NaHCO3 |
| C.与稀盐酸反应的剧烈程度:Na2CO3 > NaHCO3 |
| D.等质量的固体与足量的盐酸反应放出CO2的质量:NaHCO3 > Na2CO3 |
C
解析试题分析:本题考查碳酸钠与碳酸氢钠的性质,明确发生的化学反应是解答本题的关键,并注意利用稳定性、与酸的反应、溶解性来分析解答;A、碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,而碳酸钠加热不分解,正确;B、常温时在水中的溶解度:Na2CO3 > NaHCO3,正确;C、分别滴加HCl溶液,碳酸钠与盐酸反应分两步进行,而碳酸氢钠一步就能完成,剧烈程度:Na2CO3 <NaHCO3,错误;D、设质量都是106g,则Na2CO3和NaHCO3的物质的量分别为1mol、106/84mol,根据Na2CO3~CO2,NaHCO3~CO2,产生的CO2的物质的量分别为1mol、106/84mol,正确。
考点:考查碳酸钠与碳酸氢钠的性质。

 名校课堂系列答案
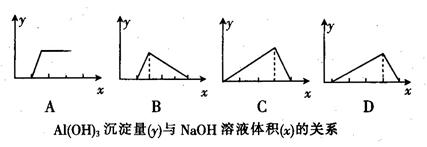
名校课堂系列答案在Al2(SO4)3和MgSO4的混合溶液中,滴加NaOH溶液,生成沉淀的量与滴入NaOH溶液的体积关系如下图所示,则原混合液中Al2(SO4)3与MgSO4的物质的量浓度之比为
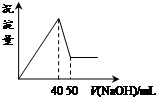
| A.1:3 | B.1:2 | C.1:1 | D.2:1 |
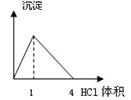
下列图像与对应的实验内容不相符的是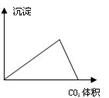
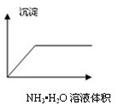
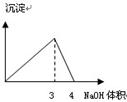
A B C D
| A.在澄清石灰水中通入CO2气体至过量 |
| B.在NaAlO2溶液中逐滴加入HCl溶液至过量 |
| C.在AlCl3溶液中逐滴加入氨水至过量 |
| D.在AlCl3溶液中逐滴加入NaOH溶液至过量 |
双羟基铝碳酸钠是医疗上常用的一种抑酸剂,其化学式是NaAl(OH)2CO3。关于该物质的说法正确的是
| A.该物质属于两性氢氧化物 |
| B.该物质是Al(OH)3和Na2CO3的混合物 |
| C.1 mol NaAl(OH)2CO3最多可消耗3 mol H+ |
| D.该药剂不适合于胃溃疡患者服用 |
C和CuO在一定温度下反应,产物有Cu、Cu2O、CO、CO2。将1.20 g C跟16.0 g CuO混合,隔绝空气加热,将生成的气体全部通过足量的澄清石灰水,反应一段时间后共收集到1.12 L气体(标准状况),生成沉淀的质量为5.00 g。下列说法正确的是
| A.反应后的固体混合物中还含有碳 |
| B.反应后的固体混合物总质量为13.6 g |
| C.反应后的固体混合物中氧化物的物质的量为0.05 mol |
| D.反应后的固体混合物中单质Cu的质量为12.8 g |
下列关于钠的叙述中,不正确的是
| A.钠燃烧时发出黄色的火焰 | B.钠燃烧时生成氧化钠 |
| C.钠有很强的还原性 | D.钠原子的最外层只有一个电子 |
有8 g Na2O2、Na2O、Na2CO3、NaOH的混合物与200 g质量分数为3.65%的盐酸恰好反应,蒸干溶液,最终得固体质量为( )
| A.8 g | B.15.5 g | C.11.7 g | D.无法计算 |