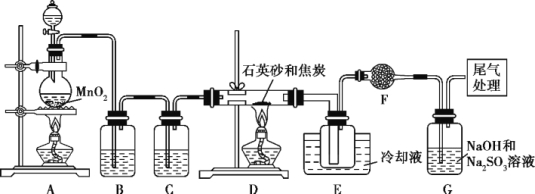
题目内容
【题目】向含有0.2 mol NaOH和0.1 mol Ba(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为8.96 L(0 ℃,1.01×105Pa)时立即停止,则这一过程中,溶液中离子的物质的量与通入CO2气体的体积关系图像正确的是(气体的溶解和离子的水解忽略不计)( )
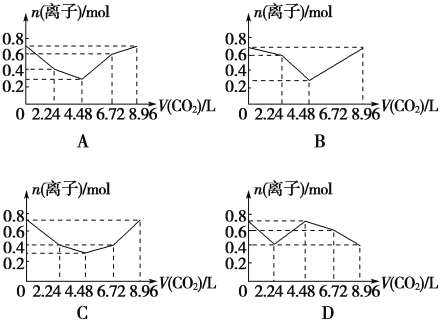
【答案】C
【解析】本题涉及的化学反应方程式:
Ba(OH)2+CO2===BaCO3↓+H2O①
2NaOH+CO2===Na2CO3+H2O②
BaCO3+CO2+H2O===Ba(HCO3)2③
Na2CO3+CO2+H2O===2NaHCO3④
当未通入CO2气体时,溶液中离子的物质的量为0.2 mol Na+、0.1 mol Ba2+、0.4 mol OH-;当通入2.24 L CO2气体时,发生反应①,此时溶液中离子的物质的量为0.2 mol Na+、0.2 mol OH-;当通入4.48 L CO2时,发生反应②,此时溶液中离子的物质的量为0.2 mol
Na+、0.1 mol CO![]() ;当通入6.72 L CO2时,发生反应④,此时溶液中离子的物质的量为0.2 mol Na+、0.2 mol HCO
;当通入6.72 L CO2时,发生反应④,此时溶液中离子的物质的量为0.2 mol Na+、0.2 mol HCO![]() ;当通入8.96 L CO2时,发生反应③,此时溶液中离子的物质的量为0.2 mol Na+、0.1 mol Ba2+、0.4 mol HCO
;当通入8.96 L CO2时,发生反应③,此时溶液中离子的物质的量为0.2 mol Na+、0.1 mol Ba2+、0.4 mol HCO![]() 。对比图像可知选项C正确。
。对比图像可知选项C正确。

 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案【题目】阅读材料,完成下列问题。
材料一:北京、成都、伦敦三地位置示意及气温曲线和降水量柱状图。
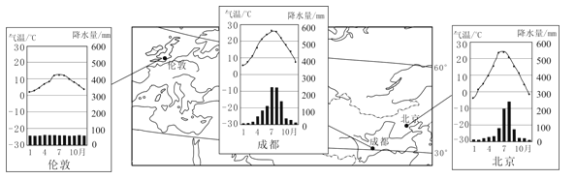
材料二:猕猴桃生长在年降水量800毫米以上的温暖湿润地区,对强光照射比较敏感,不耐旱涝。猕猴桃的生长期为210~240天,其中发芽期气温需高于10℃,结果期气温需高于20℃。
(1)英国伦敦位于亚欧大陆 侧,受盛行 风和 (填洋流性质)的影响,形成典型的温带海洋性气候。
(2)与伦敦相比,北京的气候特点是 (多项选择)。
A.全年气温变化小 | B.夏季气温高 |
C.降水量季节变化大 | D.冬季气候湿润 |
(3)与北京相比,成都冬季气温更高,其主要影响因素是 、 。
(4)北京、成都、伦敦三地中适合种植猕猴桃的是 ,并说明理由。