题目内容
【题目】晶体硅是一种重要的非金属材料。制备纯硅的主要步骤如下:
①高温下用碳还原二氧化硅制得粗硅;
②粗硅与干燥HCl气体反应制得SiHCl3:Si+3HCl![]() SiHCl3+H2;
SiHCl3+H2;
③SiHCl3与过量H2在1 000~1 100 ℃反应制得纯硅。
已知SiHCl3能与H2O剧烈反应,在空气中易自燃。请回答下列问题:
(1)第①步制备粗硅的化学反应方程式为______________________________。
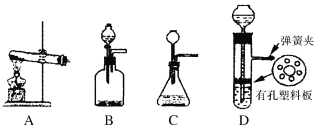
(2)用SiHCl3与过量H2反应制备纯硅的装置如图所示(热源及夹持装置均已略去):

①装置B中的试剂是________。装置C中的烧瓶需要加热,其目的是_________________________。
②反应一段时间后,装置D中观察到的现象是__________________________________,装置D不能采用普通玻璃管的原因是___________________________________________,装置D中发生反应的化学方程式为____________________________________________________。
③为保证制备纯硅实验的成功,操作的关键是检查实验装置的气密性、控制好反应温度以及_______________________________________。
【答案】(1)SiO2+2C![]() Si+2CO↑
Si+2CO↑
(2)①浓硫酸 使滴入烧瓶中的SiHCl3汽化
②有固体物质生成 在反应温度下,普通玻璃会软化 SiHCl3+H2![]() Si+3HCl
Si+3HCl
③排尽装置中的空气
【解析】(1)根据题给信息,粗硅可以用碳还原二氧化硅的方法制得,反应方程式为SiO2+2C![]() Si+2CO↑。
Si+2CO↑。
(2)①因SiHCl3与水剧烈反应,故A中产生的H2必须干燥,B中液体为浓硫酸,且C中烧瓶需加热,其目的是使SiHCl3汽化,加快与H2的反应。②制取纯硅的反应条件为1 000~1 100 ℃,此温度下普通玻璃易软化。③因高温下H2与O2易反应而爆炸,故还应排尽装置中的空气。

 阅读快车系列答案
阅读快车系列答案