题目内容
【题目】【2017高考江苏】砷(As)是一些工厂和矿山废水中的污染元素,使用吸附剂是去除水中砷的有效措 施之一.
(1)将硫酸锰、硝酸钇与氢氧化钠溶液按一定比例混合,搅拌使其充分反应,可获得一种砷的高效吸附剂X,吸附剂X中含有CO32﹣,其原因是 .
(2)H3AsO3和H3AsO4水溶液中含砷的各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系分别如图﹣1和图﹣2所示.
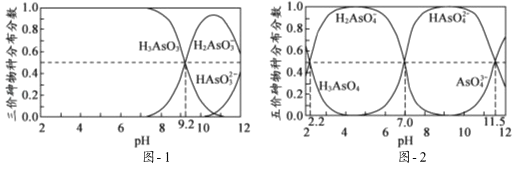
①以酚酞为指示剂(变色范围pH 8.0~10.0),将NaOH溶液逐滴加入到H3AsO3溶液中,当溶液由无色变为浅红色时停止滴加.该过程中主要反应的离子方程式为 .
②H3AsO4第一步电离方程式H3AsO4H2AsO4﹣+H+的电离常数为Ka1,则pKa1= (p Ka1=﹣lg Ka1 ).
(3)溶液的pH对吸附剂X表面所带电荷有影响.pH=7.1时,吸附剂X表面不带电荷; pH>7.1时带负电荷,pH越高,表面所带负电荷越多;pH<7.1时带正电荷,pH越低,表面所带正电荷越多.pH不同时吸附剂X对三价砷和五价砷的平衡吸附量(吸附达平衡时单位质量吸附剂X吸附砷的质量)如图﹣3所示.
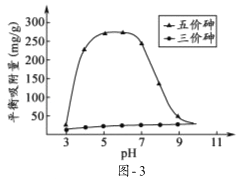
①在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降,其原因是 .
②在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,这是因为 . 提高吸附剂X对三价砷去除效果可采取的措施是 .
【答案】(1)碱性溶液吸收了空气中的CO2 (2)①OH﹣+H3AsO3=H2AsO3﹣+H2O ② 2.2 (3)①在pH7~9之间,随pH升高H2AsO4﹣转变为HAsO42﹣,吸附剂X表面所带负电荷增多,静电斥力增加 ②在pH4~7之间,吸附剂X表面带正电,五价砷主要以H2AsO4﹣和HAsO42﹣阴离子存在,静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X表面产生的静电引力小;加入氧化剂,将三价砷转化为五价砷
【解析】(1)空气中的CO2属于酸性氧化物,能溶于强碱溶液,NaOH是碱,能吸收空气中的二氧化碳而生成碳酸根离子,所以其原因是碱性溶液吸收了空气中的CO2;
(2)①根据图知,碱性条件下H3AsO3的浓度减小、H2AsO3﹣浓度增大,说明碱和H3AsO3生成H2AsO3﹣,该反应为酸碱的中和反应,同时还生成水,离子方程式为OH﹣+H3AsO3=H2AsO3﹣+H2O;
②Ka1=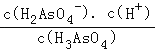 ,pH=2.2时c(H+)=10﹣2.2 mol/L,c(H3AsO3)=c(H2AsO3﹣),p Ka1=﹣lg Ka1=﹣lg
,pH=2.2时c(H+)=10﹣2.2 mol/L,c(H3AsO3)=c(H2AsO3﹣),p Ka1=﹣lg Ka1=﹣lg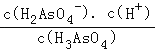 =2.2;
=2.2;
(3)①吸附剂X表面所带负电荷增多,静电斥力越大,在pH7~9之间,随pH升高H2AsO4﹣转变为HAsO42﹣,吸附剂X表面所带负电荷增多,静电斥力增加,导致在pH7~9之间,吸附剂X对五价砷的平衡吸附量随pH升高而迅速下降;
②在pH4~7之间,吸附剂X表面带正电,五价砷主要以H2AsO4﹣和HAsO42﹣阴离子存在,pH<7.1时带正电荷,pH越低,表面所带正电荷越多,所以静电引力较大;而三价砷主要以H3AsO3分子存在,与吸附剂X表面产生的静电引力小,所以在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱;在pH4~7之间,吸附剂X对水中三价砷的去除能力远比五价砷的弱,如果能将三价砷转化为五价砷,能有效的去除三价砷,所以采取的措施是加入氧化剂,将三价砷转化为五价砷。