题目内容
【题目】【2017和平区一模】25℃时,将1.0L w molL﹣1“爽朗”的CH3COOH溶液与0.1mol“苦涩”的 NaOH固体混合,充分反应后向混合液中通(加)入HCl气体或NaOH固体,溶液pH随加入HCl或NaOH的物质的量而变化如图.下列叙述正确的是( )
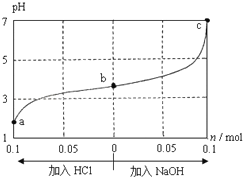
A.a、b、c 对应的混合液中,水的电离程度由大到小的顺序的是a>b>c
B.c点混合液中c(Na+)>c(CH3COO﹣)
C.加入NaOH过程中,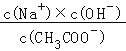 减小
减小
D.若忽略体积变化,则25℃时CH3COOH的电离平衡常数 K=![]() ×10﹣7 molL﹣1
×10﹣7 molL﹣1
【答案】D
【解析】1.0L w molL﹣1 CH3COOH溶液与0.1mol NaOH固体混合,混合后溶液的pH<5,显酸性,说明醋酸过量,溶液中溶质为CH3COOH和CH3COONa;加盐酸时,CH3COONa与盐酸反应生成CH3COOH;加NaOH时,NaOH与CH3COOH反应生成CH3COONa;A.溶液中酸或碱电离的氢离子或氢氧根离子的浓度越大,水的电离程度越小,a、b、c三点溶液中氢离子浓度依次减小,水的电离程度增大,所以水的电离程度由大到小的顺序的是c>b>a,故A错误;B.c点pH=7,则c(H+)=c(OH﹣),溶液中电荷守恒为:c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣),所以c(Na+)=c(CH3COO﹣),故B错误;C.加入NaOH过程中,c(Na+)和c(OH﹣)增大,c(Na+)的增大大于c(CH3COO﹣)的增大,所以加入NaOH过程中, 增大,故C错误;D.pH=7时,c(H+)=10﹣7molL﹣1,c(Na+)=c(CH3COO﹣)=0.2mol/L,Ka=
增大,故C错误;D.pH=7时,c(H+)=10﹣7molL﹣1,c(Na+)=c(CH3COO﹣)=0.2mol/L,Ka= =
=![]() ×10﹣7 molL﹣1,故D正确;故选D。
×10﹣7 molL﹣1,故D正确;故选D。