题目内容
【题目】如下图所示的装置中,若通入直流电5 min时,铜电极质量增加2.16 g,试回答:
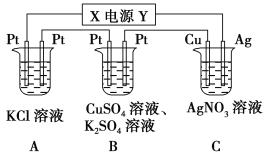
(1)电源电极X的名称为________。
(2)pH变化:A________,B________,C________。(填“增大”“减小”或“不变”)
(3)通电5 min后,B中共收集224 mL气体(标准状况),溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为________(设电解前后溶液体积无变化)。
(4)若A中KCl溶液的体积也是200 mL,电解后,溶液中OH的物质的量浓度为________(设电解前后溶液体积无变化)。
【答案】(1)负极
(2)增大 减小 不变
(3)0.025 mol·L1 (4)0.1 mol·L1
【解析】(1)C装置的铜电极质量增加,说明铜极上有金属析出,即溶液中的银离子被还原生成银单质,故铜极为阴极,由此可确定X极为负极。
(2)A装置是电解KCl溶液,阴极析出氢气,阳极析出氯气,溶液中氢氧根离子浓度增大,B装置中阴极上先析出铜,当铜离子消耗完后将析出氢气,而阳极上析出氧气,溶液中氢离子浓度增大,C装置中阴极析出银单质,阳极上的银失去电子变成银离子,理论上AgNO3溶液的物质的量浓度不变。
(3)B装置两极上电子转移的数目与C装置中转移的电子数目相同,C装置中转移的电子为![]() =0.02 mol,经判断,B装置中阴极:Cu2++2e===Cu,2H++2e===H2↑,阳极:4OH4e===O2↑+2H2O,根据题意可得:2n(H2)+2n(Cu)=4n(O2)=0.02 mol,n(H2)+n(O2)=
=0.02 mol,经判断,B装置中阴极:Cu2++2e===Cu,2H++2e===H2↑,阳极:4OH4e===O2↑+2H2O,根据题意可得:2n(H2)+2n(Cu)=4n(O2)=0.02 mol,n(H2)+n(O2)=![]() ,解得n(Cu)=0.005 mol,CuSO4溶液物质的量浓度为:
,解得n(Cu)=0.005 mol,CuSO4溶液物质的量浓度为:![]() =0.025 mol·L1。
=0.025 mol·L1。
(4)A装置的反应为:2KCl+2H2O![]() 2KOH+H2↑+Cl2↑,即反应中电子转移的物质的量与生成的氢氧根离子的物质的量相等,为0.02 mol,c(OH)=
2KOH+H2↑+Cl2↑,即反应中电子转移的物质的量与生成的氢氧根离子的物质的量相等,为0.02 mol,c(OH)= ![]() =0.1 mol·L1。
=0.1 mol·L1。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案