题目内容
【题目】【2014江苏模拟】善于提出问题、探究问题和解决问题是学好化学的重要的方法.某同学在学习铁及其化合物知识时提出了下列问题:
问题1:铁为何称为黑色金属?
问题2:经查证,氧化性:Fe2O3>Fe3O4>FeO,用CO还原氧化铁得到的黑色固体一定是单质铁吗?有没有生成Fe3O4或FeO的可能?
问题3:Fe3+和SO32﹣之间可能发生的反应有:2Fe3++SO32﹣+H2O═2Fe2++SO42﹣+2H+(氧化还原反应),2Fe3++3SO32﹣+6H2O═2Fe(OH)3(胶体)+3H2SO3(水解反应).实际反应究竟是哪一个?
(1)对于问题1,同学们上网查寻,有两种解释:
A.因为在铁表面上有黑色的铁的氧化物,所以叫黑色金属.
B.因为铁的粉末为黑色,铁的氧化物也均为黑色,所以叫黑色金属.
①你认为正确的说法是 ;
②有一黑色粉末,可能是铁粉、Fe3O4粉末、FeO粉末中的一种,请你设计一种实验方案进行检验 ;
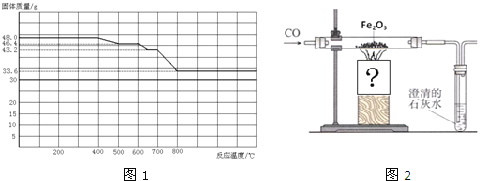
(2)对于问题2,同学们 参观了某钢铁厂,获得了用SDTQ热分析仪对CO与Fe2O3进行热反应的有关数据,绘制成固体质量与反应温度的关系曲线图(见图1)
①根据图象分析,反应温度500℃﹣600℃时残留固体的成分是 ;
②写出固体质量由43.2 g变为33.6 g时的化学方程式 ;
③已知:酒精灯火焰温度为600℃左右,酒精喷灯火焰温度高于800℃.钢铁厂有含铁、Fe2O3、Fe3O4、FeO的混合粉末,某同学为了帮助钢铁厂测定其含铁元素的质量分数,称取m1g样品,设计了如图2所示的实验装置进行实验,当铁的氧化物全部还原为铁时,在CO的保护下冷却,称得残留固体的质量为m2g.实验时应选择 灯加热,判断铁的氧化物全部还原为铁的方法是 .该装置还有没有缺陷?如果有,请提出改进意见 (如没有,该空不填);
(3)对于问题3,同学们进行了实验探究:取5 mL FeCl3溶液于试管中,逐滴加入Na2SO3液至过量,观察到溶液颜色由黄色逐渐变为红褐色,无气泡产生,无沉淀生成,但有丁达尔现象.取红褐色液体少许,逐滴加入稀盐酸至过量,加入BaCl2溶液,有少量白色沉淀生成.据此实验现象,你得出的结论是 。
【答案】(1)①A ②取少量样品加入稀盐酸,产生气泡,说明是铁,若没有产生气泡,继续滴加KSCN溶液,若溶液变血红色,说明是Fe3O4,没有变血红色说明是FeO
(2)①Fe3O4、FeO ②FeO+CO![]() Fe+CO2 ③酒精喷灯;最后两次称量质量差小于0.1g;在排放尾气的导气管口放一盏燃着的酒精灯
Fe+CO2 ③酒精喷灯;最后两次称量质量差小于0.1g;在排放尾气的导气管口放一盏燃着的酒精灯
(3)两个反应均发生
【解析】(1)①铁是在高温下炼制成,高温下会和空气中的氧气反应生成四氧化三铁或氧化铁,颜色都是黑色氧化物,氧化铁是红色氧化物时常温下缓慢氧化或电话腐蚀生成得到,故答案为A;
②金属铁能与稀盐酸反应放出氢气,铁离子能使KSCN溶液显血红色,故验证方法是:取少量样品加入稀盐酸,产生气泡,说明是铁,若没有产生气泡,继续滴加KSCN溶液,若溶液变血红色,说明是Fe3O4,没有变血红色说明是FeO;
(2)①根据氧化性Fe2O3>Fe3O4>FeO可知,与CO发生反应时,Fe2O3优先反应,然后Fe3O4反应,最后FeO反应,根据图象曲线可知,加热到400﹣500℃Fe2O3逐渐反应,到500℃时Fe2O3反应完全,此时固体混合物为Fe3O4、FeO;
②固体质量由43.2g变为33.6g时,对应温度为700﹣800℃,此时Fe2O3、Fe3O4已经反应完全,FeO开始与CO反应,反应的化学方程式为:FeO+CO![]() Fe+CO2;
Fe+CO2;
③酒精灯火焰温度为600℃左右,酒精喷灯火焰温度高于800℃,而该反应需要加热到800℃,所以只能选用酒精喷灯加热;当最后两次称量质量差小于0.1g,则氧化物全部还原为铁;由于反应中用到的还原剂CO有毒,不能直接排放,应该在排放尾气的导气管口放一盏燃着的酒精灯,将多余的CO气体通过燃烧除掉;
(3)用稀释的FeCl3和Na2SO3溶液实验,观察到溶液颜色由黄色逐渐变为红褐色,无气泡产生,无沉淀生成,但有丁达尔现象,证明有氢氧化铁胶体生成,取红褐色液体少许,逐滴加入稀盐酸至过量,加入BaCl2溶液,有少量白色沉淀生成,证明了Fe3+与SO32﹣发生氧化还原反应生成SO42﹣,故氧化还原反应和双水解反应是同时进行的。

 活力课时同步练习册系列答案
活力课时同步练习册系列答案