题目内容
【题目】测定1 mol氧气在标准状况下所占体积的实验操作的步骤如下:
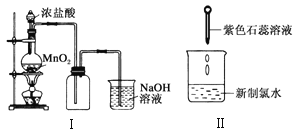
①按下图装配实验装置。
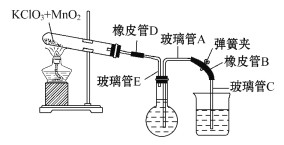
②洗净试管然后充分干燥。
③向500 mL烧瓶里装满水,向500 mL烧杯里加入少量水,把连接烧瓶和烧杯的玻璃管A、橡皮管B和玻璃管C中也装满水,在中间不要留下气泡,然后用弹簧夹把橡皮管B夹紧。
④称得试管的质量为14.45 g,往试管里加入KClO3和MnO2的混合物,再称其质量为15.95 g。
⑤打开弹簧夹,把烧杯举起使烧瓶和烧杯中的水面一致,再关闭弹簧夹,然后把烧杯中的水倒掉。
⑥打开弹簧夹,加热试管的混合物到不再产生气体,即水不再流向烧杯时为止。
⑦反应完毕后把装置冷却到室温。
⑧调节烧杯的高度使烧瓶和烧杯中的水面一致,然后再关闭弹簧夹。
⑨用500 mL量筒测量烧杯里水的体积为285.0 mL,把它换算为标准状况下氧气的体积为279.7 mL。
⑩再称量冷却后试管的质量为15.55 g。
(1)在操作⑦中,装置冷却时,玻璃管C的出口一直要在烧杯的水中,不能离开水面,其理由是________________________________。
(2)简述操作⑧的必要性,即为什么要调节烧杯的高度,使烧瓶和烧杯中的水面一致?________________________________。
(3)标准状况下,1 mol氧气所占的体积(保留至小数点后两位)为________L;混合物中MnO2的质量分数为________。
【答案】(1)温度降低时,烧瓶内的压强降低,这时烧杯中的水就会回流,从而可以准确地求出气体的体积
(2)使烧瓶中的压强和外界大气压一致,否则,就不能准确地求出气体体积
(3)22.38 32%
【解析】这是一道利用阿伏加德罗定律测定1 mol氧气标准状况下所占体积的实验题。其原理是通过测量氧气排出的水的体积,进而确定产生的氧气的体积,成功的关键是烧瓶内的气体在反应前后是否处于同一状态,即是否同温同压,由于气体体积的大小受温度、压强的影响,若烧杯内的液面与烧瓶中的液面不一致,则造成压强与外界大气压不一致,使误差增大。若反应完后未冷却至室温,则会更多地偏离标准状况,使结果不准确。

 浙江名校名师金卷系列答案
浙江名校名师金卷系列答案 全优冲刺100分系列答案
全优冲刺100分系列答案