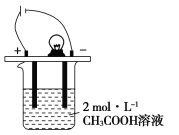
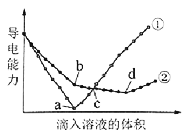
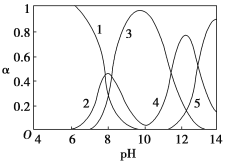
题目内容
【题目】1.为探究从镀银车间的废液中回收银的效果,某化学兴趣小组的同学在25 ℃时进行了下列分析:
(1)他们取了35 L Ag+浓度为6×103 mol·L1的某镀银车间回收液,然后加入0.012 mol·L1NaCl溶液25 L,此时 (填“能”或“不能”)观察到AgCl沉淀。
(2)最后该溶液中的c(Ag+)为 ,生成AgCl的质量为 。
(3)AgCl在上述溶液中的溶解度与在纯水中的相比, 中的溶解度较大。
[已知Ksp(AgCl)=1.8×1010]
【答案】(1)能 (2)1.2×107 mol·L1 30.1 g (3)纯水
【解析】(1)两溶液混合后Ag+和Cl的浓度都会减小,混合后c(Ag+)=![]() =3.5×103 mol·L1、c(Cl)=
=3.5×103 mol·L1、c(Cl)=![]() =5.0×103 mol·L1,Qc= c(Ag+)·c(Cl) = 3.5 × 103 × 5.0 × 103 = 1.75×105>Ksp(AgCl),故有沉淀生成。
=5.0×103 mol·L1,Qc= c(Ag+)·c(Cl) = 3.5 × 103 × 5.0 × 103 = 1.75×105>Ksp(AgCl),故有沉淀生成。
(2)因为c(Ag+)<c(Cl),生成AgCl沉淀时Cl是过量的。设平衡时c(Ag+)=x,溶液中存在平衡:AgCl(s)![]() Ag+(aq)+Cl(aq),则Cl减少的浓度为3.5×103 mol·L1x,故平衡时c(Cl)=1.5×103 mol·L1+x,因而Ksp(AgCl)=c(Ag+)·c(Cl)=x·(1.5×103 mol·L1+x)=1.8×1010,因x值非常小,1.5×103 mol·L1+x≈1.5×103 mol·L1,解得x=1.2×107 mol·L1,说明Ag+沉淀完全。生成AgCl沉淀时,Cl是过量的,故析出AgCl的质量为m(AgCl)=3.5×103 mol·L1×60 L×143.5 g·mol1≈30.1 g。
Ag+(aq)+Cl(aq),则Cl减少的浓度为3.5×103 mol·L1x,故平衡时c(Cl)=1.5×103 mol·L1+x,因而Ksp(AgCl)=c(Ag+)·c(Cl)=x·(1.5×103 mol·L1+x)=1.8×1010,因x值非常小,1.5×103 mol·L1+x≈1.5×103 mol·L1,解得x=1.2×107 mol·L1,说明Ag+沉淀完全。生成AgCl沉淀时,Cl是过量的,故析出AgCl的质量为m(AgCl)=3.5×103 mol·L1×60 L×143.5 g·mol1≈30.1 g。
(3)AgCl溶液中存在下列平衡AgCl(s)![]() Ag+(aq)+Cl(aq),根据题意可知生成AgCl沉淀时Cl过量,相当于增大了Cl浓度,使得上述平衡逆向移动,故AgCl溶解度降低。
Ag+(aq)+Cl(aq),根据题意可知生成AgCl沉淀时Cl过量,相当于增大了Cl浓度,使得上述平衡逆向移动,故AgCl溶解度降低。