题目内容
【题目】某学习小组依据SO2具有还原性,推测SO2能被Cl2氧化生成SO2Cl2。查阅资料:SO2Cl2在常温下为无色液体,极易水解,遇潮湿空气会产生白雾。
Ⅰ.化合物SO2Cl2中S元素的化合价是 。
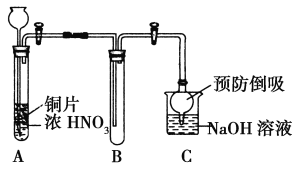
Ⅱ.用二氧化锰和浓盐酸制氯气的化学方程式是 。
Ⅲ.在收集氯气前,应依次通过盛有饱和食盐水和 的洗气瓶。
Ⅳ.用如图所示装置收集满Cl2,再通入SO2,集气瓶中立即产生无色液体,充分反应后,将液体和剩余气体分离,进行如下研究。
(1)研究反应的产物。向所得液体中加水,出现白雾,振荡、静置得到无色溶液。经检验该溶液中的阴离子(除OH-外)只有SO42-、Cl-,证明无色液体是SO2Cl2。
①写出SO2Cl2与H2O反应的化学方程式: 。
②检验该溶液中Cl-的方法是 。
(2)继续研究反应进行的程度。用NaOH溶液吸收分离出的气体,用稀盐酸酸化后,再滴加BaCl2溶液,产生白色沉淀。
①该白色沉淀的成分是 。
② 写出SO2与Cl2反应的化学方程式,并阐述理由
【答案】Ⅰ.+6价
Ⅱ.MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
Ⅲ.浓硫酸
Ⅳ.(1)①SO2Cl2+2H2O![]() H2SO4+2HCl
H2SO4+2HCl
②取少量该溶液于试管中,加入过量Ba(NO3)2溶液,过滤,向滤液中加入AgNO3溶液,若产生白色沉淀,则说明溶液中有Cl-
(2)①BaSO4
②SO2+Cl2![]() SO2Cl2;由于白色沉淀是BaSO4,所以反应后的混合气体中必然存在SO2和Cl2两种气体。因此SO2和Cl2生成SO2Cl2的反应为可逆反应
SO2Cl2;由于白色沉淀是BaSO4,所以反应后的混合气体中必然存在SO2和Cl2两种气体。因此SO2和Cl2生成SO2Cl2的反应为可逆反应
【解析】Ⅰ.在化合物中,各元素的化合价的代数和为0。化合物SO2Cl2中氧元素为-2价,Cl元素为-1价,故S元素的化合价是+6价。
Ⅱ.用二氧化锰和浓盐酸制氯气的化学方程式是MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
Ⅲ.在收集氯气前,应先通过饱和食盐水除去氯气中的氯化氢,再通过浓硫酸除去氯气中的水蒸气。
Ⅳ.(1)①SO2Cl2与H2O反应的化学方程式为SO2Cl2+2H2O![]() H2SO4+2HCl;
H2SO4+2HCl;
②溶液中存在SO42-和Cl-,因SO42-与Ag+反应也能产生白色沉淀,干扰Cl-的检验,所以在检验Cl-之前必须将SO42-除去。
(2)因反应后产生了白色沉淀,所以分离后的气体中必定含有SO2和Cl2,即SO2与Cl2生成SO2Cl2的反应为可逆反应。

 应用题作业本系列答案
应用题作业本系列答案 暑假作业暑假快乐练西安出版社系列答案
暑假作业暑假快乐练西安出版社系列答案