题目内容
【题目】工厂中用稀硫酸浸泡某矿石后的溶液中,除了含有大量硫酸外,还含有少量![]() 、Fe3+、
、Fe3+、![]() 、Cl。为除去杂质离子,部分操作流程如下:
、Cl。为除去杂质离子,部分操作流程如下:
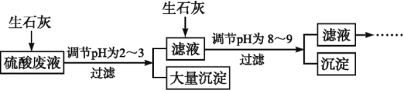
请回答下列问题:
(1)用稀硫酸浸泡某矿石后的溶液中,硫酸的浓度为4.9 g·L1,则该溶液中的pH约为 。
(2)![]() 在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在。现有一份(NH4)2SO4溶液、一份NH4Cl溶液,(NH4)2SO4溶液中c(
在用稀硫酸浸泡某矿石后的溶液中以(NH4)2SO4和NH4Cl形式存在。现有一份(NH4)2SO4溶液、一份NH4Cl溶液,(NH4)2SO4溶液中c(![]() )恰好是NH4Cl溶液中c(
)恰好是NH4Cl溶液中c(![]() )的2倍,则c[(NH4)2SO4] (填“<”“=”或“>”)c(NH4Cl)。
)的2倍,则c[(NH4)2SO4] (填“<”“=”或“>”)c(NH4Cl)。
(3)随着向废液中投入生石灰(忽略溶液温度的变化),溶液中![]() (填“增大”“减小”或“不变”)。
(填“增大”“减小”或“不变”)。
(4)投入生石灰调节pH到2~3时,大量沉淀的主要成分为CaSO4·2H2O[含有少量Fe(OH)3],提纯CaSO4·2H2O的主要操作步骤:向沉淀中加入过量 ,充分反应后,过滤、洗涤、 。
(5)25 ℃,H3AsO4电离常数为K1=5.6×103,K2=1.7×107,K3=4.0×1012。当溶液中pH调节到8~9时,沉淀主要成分为Ca3(AsO4)2。
①pH调节到8左右Ca3(AsO4)2才开始沉淀的原因是 。
②Na3AsO4第一步水解的平衡常数数值为 。
③已知:![]() +2I+2H+
+2I+2H+![]()
![]() +I2+H2O,SO2+I2+2H2O
+I2+H2O,SO2+I2+2H2O![]()
![]() +2I+4H+。这两个反应中还原性最强的微粒是 。
+2I+4H+。这两个反应中还原性最强的微粒是 。
【答案】(15分,除标明外,每空2分)
(1)1
(2)<
(3)减小
(4)稀硫酸 晾干或干燥(1分)
(5)①H3AsO4是弱酸,当溶液中pH调节到8左右时c(![]() )增大,Ca3(AsO4)2开始沉淀 ②2.5×103 ③SO2
)增大,Ca3(AsO4)2开始沉淀 ②2.5×103 ③SO2
【解析】(1)1 L溶液中n(H2SO4)=![]() =0.05 mol,所以c(H+)=0.1 mol·L1,则pH=1;
=0.05 mol,所以c(H+)=0.1 mol·L1,则pH=1;
(2)c(![]() )小的NH4Cl溶液中
)小的NH4Cl溶液中![]() 的水解程度大,所以c(NH4Cl)>c[(NH4)2SO4];
的水解程度大,所以c(NH4Cl)>c[(NH4)2SO4];
(3)Ca(OH)2使溶液中的c(OH)增大,![]() +H2O
+H2O![]() NH3·H2O+H+平衡右移,但c(OH)增大的程度大于c(NH3·H2O),所以
NH3·H2O+H+平衡右移,但c(OH)增大的程度大于c(NH3·H2O),所以![]() 减小;
减小;
(4)Fe(OH)3溶于稀硫酸,而CaSO4·2H2O在稀硫酸中的溶解度很小;
(5)①H3AsO4是弱酸,当溶液中pH调节到8左右时c(![]() )增大,Ca3(AsO4)2开始沉淀。②
)增大,Ca3(AsO4)2开始沉淀。②![]() +H2O
+H2O![]()
![]() +OH的Kb=
+OH的Kb=![]() =
=![]() =2.5×103。③由
=2.5×103。③由![]() +2I+2H+
+2I+2H+![]()
![]() +I2+H2O,SO2+I2+2H2O
+I2+H2O,SO2+I2+2H2O![]()
![]() +2I+4H+可知,反应中还原性最强的微粒是SO2。
+2I+4H+可知,反应中还原性最强的微粒是SO2。

 阅读快车系列答案
阅读快车系列答案