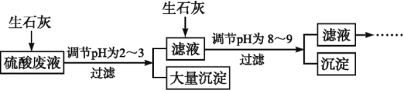
题目内容
【题目】已知:①H2(g)+![]() O2(g)
O2(g) ![]() H2O(l) ΔH1=285.8 kJ·mol1
H2O(l) ΔH1=285.8 kJ·mol1
②H2(g) ![]() H2(l) ΔH2=0.92 kJ·mol1
H2(l) ΔH2=0.92 kJ·mol1
③O2(g) ![]() O2 (l) ΔH3=6.84 kJ·mol1
O2 (l) ΔH3=6.84 kJ·mol1
④H2O(g) ![]() H2O (l) ΔH4=44 kJ·mol1
H2O (l) ΔH4=44 kJ·mol1
下列说法正确的是
A.1 mol H2(g)和0.5 mol O2(g)具有的总能量小于1 mol H2O(l)具有的能量
B.H2(g)和O2(g)完全燃烧生成H2O(l)释放出142.9 kJ热量时,有0.5 mol H—O键形成
C.H2的燃烧热ΔH=285.8 kJ·mol1
D.高温下液氢燃烧的热化学方程式为:H2(l)+![]() O2(l)
O2(l)![]() H2O(g) ΔH=241.8 kJ·mol1
H2O(g) ΔH=241.8 kJ·mol1
【答案】C
【解析】反应①为放热反应,反应物总能量大于生成物总能量,A项错误。根据反应①可知,1 mol H2O含有2 mol H—O键,所以H2(g)燃烧释放出142.9 kJ热量时生成0.5 mol H2O(l),形成1 mol H—O键,B项错误。由燃烧热的定义知,1 mol H2(g)完全燃烧生成液态水释放的热量为其燃烧热,H2的燃烧热ΔH=285.8 kJ·mol1,C项正确。根据盖斯定律,①②![]() ×③④可得:H2(l)+
×③④可得:H2(l)+![]() O2(l)
O2(l)![]() H2O(g) ΔH=237.46 kJ·mol1,D项错误。
H2O(g) ΔH=237.46 kJ·mol1,D项错误。

练习册系列答案
相关题目