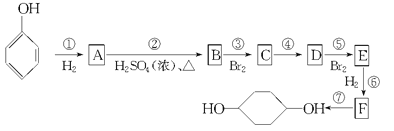
题目内容
【题目】指出下列原子的杂化轨道类型及分子的结构式、立体构型。
(1)CS2分子中的C原子采取 杂化,分子的结构式为 ,立体构型为 ;
(2)CH2O中的C原子采取 杂化,分子的结构式为 ,立体构型为 ;
(3)CCl4分子中的C原子采取 杂化,分子的结构式为 ,立体构型为 ;
(4)H2S分子中的S原子采取 杂化,分子的结构式为 ,立体构型为 。
【答案】(1)sp S![]() C
C![]() S 直线形
S 直线形
(2)sp2 ![]() 平面三角形
平面三角形
(3)sp3 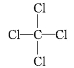 正四面体形
正四面体形
(4)sp3 ![]() V形
V形
【解析】杂化轨道所用原子轨道的能量相近,且杂化轨道只能用于形成σ键,剩余的p轨道可以形成π键。杂化轨道类型决定了分子(或离子)的立体构型,如sp2杂化轨道的夹角为120°,立体构型为平面三角形。因此,也可根据分子的立体构型确定分子(或离子)中杂化轨道的类型,如CO2为直线形分子,因此分子中杂化轨道类型为sp杂化。

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案
相关题目