题目内容
【题目】(1)从氧化还原的角度分析水在下列化学反应中的作用(从氧化剂、还原剂角度分析)。
①电解水:_____________________________________________________。
②钠和水的反应(2Na+2H2O![]() 2NaOH+H2↑):_______________________________。
2NaOH+H2↑):_______________________________。
③氟气和水反应(2F2+2H2O![]() 4HF+O2):_______________________________。
4HF+O2):_______________________________。
④氯气和水反应(Cl2+H2O![]() HCl+HClO):______________________________。
HCl+HClO):______________________________。
(2)某一反应体系中有反应物和生成物共5种物质:S、H2S、HNO3、NO、H2O。该反应体系中还原产物是________;若反应中转移了0.3 mol电子,则氧化产物的质量是________g。
(3)将少量Cl2通入FeBr2的溶液中,反应的离子方程式为2Fe2++Cl2![]() 2Fe3++2Cl,这个事实说明具有还原性的粒子还原性强弱顺序为____________。足量Cl2通入FeBr2溶液中发生反应的离子方程式为________________。
2Fe3++2Cl,这个事实说明具有还原性的粒子还原性强弱顺序为____________。足量Cl2通入FeBr2溶液中发生反应的离子方程式为________________。
【答案】(1)①既作氧化剂,又作还原剂 ②作氧化剂 ③作还原剂 ④既不作氧化剂,也不作还原剂
(2)NO 4.8
(3)Fe2+>Br>Cl 2Fe2++4Br+3Cl2![]() 2Fe3++2Br2+6Cl
2Fe3++2Br2+6Cl
【解析】(1) 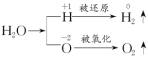
所以在反应①中H2O既作氧化剂又作还原剂,在反应②中水只作氧化剂,在反应③中H2O只作还原剂,在反应④中H2O既不作氧化剂也不作还原剂。
(2)由于HNO3具有强氧化性,H2S具有还原性,此反应为HNO3将H2S氧化成S,自身被还原为NO,转移2 mol e时生成32 g S,当转移0.3 mol电子时,得到S的质量为4.8 g。
(3)Fe2+、Br均具有还原性,当通入少量Cl2时只有Fe2+被氧化,说明还原性Fe2+>Br>Cl,当通入足量Cl2时,Fe2+和Br将按1∶2完全被氧化,离子方程式为2Fe2++4Br+3Cl2![]() 2Fe3++2Br2+6Cl。
2Fe3++2Br2+6Cl。

 智能训练练测考系列答案
智能训练练测考系列答案 计算高手系列答案
计算高手系列答案