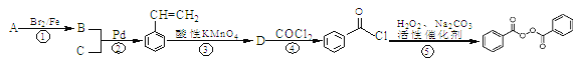
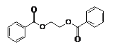
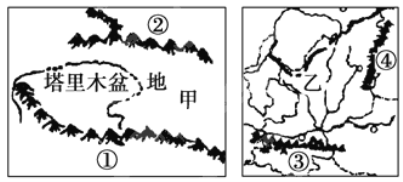
题目内容
【题目】向20 mL盐酸和硫酸的混合液中加入0.05 mol·L1的Ba(OH)2溶液,生成BaSO4沉淀的量及溶液pH的变化如图所示。下列说法正确的是
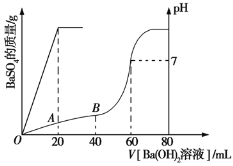
A.A点时,pH=2
B.B点时,pH=4
C.硫酸的物质的量浓度为0.1 mol·L1
D.盐酸的物质的量浓度为0.2 mol·L1
【答案】D
【解析】由图知,加入20 mL Ba(OH)2溶液时沉淀完全:![]() +Ba2+
+Ba2+ ![]() BaSO4↓,n(H2SO4)=n[Ba(OH)2] =0.05 mol·L1×0.02 L=0.001 mol,c(H2SO4)=
BaSO4↓,n(H2SO4)=n[Ba(OH)2] =0.05 mol·L1×0.02 L=0.001 mol,c(H2SO4)=![]() =0.05 mol·L1。加入60 mL Ba(OH)2溶液时,溶液呈中性,所以c(HCl)=(0.05 mol·L1×0.06 L×20.05 mol·L1×0.02 L×2)÷0.02 L=0.2 mol·L1。A点时,加入的Ba(OH)2与硫酸刚好完全反应,此时溶液中的H+全部来自盐酸的电离(水的电离忽略不计),则有c(H+)=(0.02 L×0.2 mol·L1)÷(0.02 L+0.02 L)=0.1 mol·L1,pH=1。B点时,c(H+)=( 0.05 mol·L1×2×0.02 L+0.02 L×0.2 mol·L10.05 mol·L1×2×0.04 L)÷(0.02 L+0.04 L)=
=0.05 mol·L1。加入60 mL Ba(OH)2溶液时,溶液呈中性,所以c(HCl)=(0.05 mol·L1×0.06 L×20.05 mol·L1×0.02 L×2)÷0.02 L=0.2 mol·L1。A点时,加入的Ba(OH)2与硫酸刚好完全反应,此时溶液中的H+全部来自盐酸的电离(水的电离忽略不计),则有c(H+)=(0.02 L×0.2 mol·L1)÷(0.02 L+0.02 L)=0.1 mol·L1,pH=1。B点时,c(H+)=( 0.05 mol·L1×2×0.02 L+0.02 L×0.2 mol·L10.05 mol·L1×2×0.04 L)÷(0.02 L+0.04 L)=![]() mol·L1≈0.03 mol·L1,pH=lg 0.03=2lg 3。综上,A、B、C项错误,D项正确。
mol·L1≈0.03 mol·L1,pH=lg 0.03=2lg 3。综上,A、B、C项错误,D项正确。

练习册系列答案
相关题目