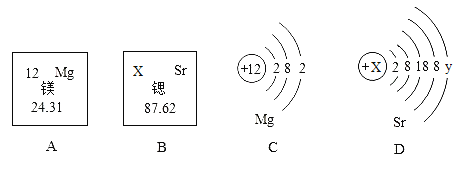
【题目】生石灰常用作食品干燥剂,干燥剂的包装袋上除了标明主要成分为生石灰外,还提醒人们注意:不可食用、不可浸水、不可开袋、不可玩耍、儿童勿取。
(1)同学们将一袋 干燥剂倒入一定 量的水中,发现生石灰开始“沸腾”,咕嘟咕嘟冒泡,不时有水蒸汽冒出,充分搅拌后过滤,得到白色沉淀和滤液。通过实验现象可知生石灰遇水会_____________(选填“吸热”或“放热”),写出有关反应的化学方程式:_________________。
(2)同学们想知道所得白色沉淀的成分,进行了如下探究:
[提出问题]白色沉淀中含有哪些物质?
[猜想假设]猜想1:只含有氢氧化钙;
猜想2:只含碳酸钙;
猜想3:_________________。
[实验探究]同学们进行了如下表所示的实验,请将下表填写完整;
实验步骤 | 现象现象 | 结论 |
I.取少量样品于试管中,加入足量的稀盐酸 | ______________ | 猜想1不成立 |
II.另取少量样品于试管中,加入适量水,充分搅拌后,滴加______________________ | 溶液呈红色 | 猜想3成立 |
[拓展延伸]①写出步骤I中发生反应的化学方程式:_________________。
②实验室正确保存生石灰的方法是_________________。
【题目】取20g碳酸钠和碳酸氢钠的固体混合物,加热至不再产生气体2NaHCO3![]() Na2CO3+H2O+CO2↑),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如表:
Na2CO3+H2O+CO2↑),使生成的水完全被浓硫酸吸收,测得加热时间和浓硫酸质量增加的关系如表:
时间 | 0分钟 | 1分钟 | 2分钟 | 3分钟 |
仪器和浓硫酸的质量总和(g) | 150 | 150.9 | 151.8 | 151.8 |
(1)当完全反应后,生成水的质量为_____g。
(2)计算混合物中碳酸氢钠的质量分数________。(要求写出计算过程)
(3)将上述混合物完全分解后的固体溶解于186.2g 水中,待固体完全溶解后所得溶液中溶质的质量分数为_____。
【题目】甲、乙两种物质的溶解度曲线如图所示,下列说法正确的是

A.将甲、乙的饱和溶液从t2℃分别降温到t1℃,析出晶体的质量甲一定大于乙 |
B.t1℃时甲、乙的饱和溶液中溶质质量分数相等 |
C.t2℃时将40g甲溶于100g水中,形成饱和溶液 |
D.将M点的甲溶液变成饱和溶液常采取的方法是__________________________。 |
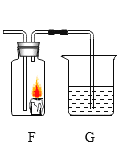
【题目】甲、乙、丙三个实验小组分别利用2g铜粉 “测定空气中氧气的含量”,实验装置见右图。课外兴趣小组为研究实验中铜粉的氧化情况,又进行以下实验:
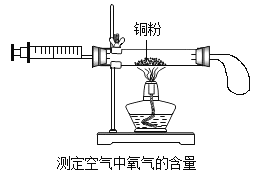
①兴趣小组将甲、乙、丙三个实验小组硬质玻璃管中的残留固体全部取出,称量后,置于烧杯中;
②在烧杯中加入足量稀硫酸使之充分反应,将剩余固体过滤、洗涤、干燥、称量;相关数据见下表:
甲组 | 乙组 | 丙组 | |
反应前固体质量 | 2.016g | 2.016g | 2.024g |
反应后固体质量 | 1.936g | 1.936g | 1.904g |
(1)烧杯中发生反应的化学方程式为__________。
(2)甲、乙两组实验数据相同,残留固体中氧化铜的质量为____________,丙组残留固体中氧化铜的质量为___________。
(3)兴趣小组通过分析数据得出:甲、乙两组实验数据更接近实际空气中氧气的含量,丙组差异较大。你认为丙组在“测定空气中氧气的含量”实验中,可能存在的操作失误是_________。