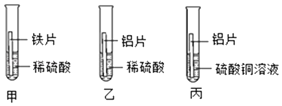
【题目】阅读下面科普短文并回答问题。
研究发现,同种元素的原子核中,中子数不一定相同,如氢元素的原子核(如下表)。
氧元素的原子核 | 原子名称 | |
质子数(Z) | 中子数(N) | |
1 | 0 | 氕 |
1 | 1 | 氘 |
1 | 2 | 氚 |
为了更好地区别同种元素的不同原子,常用原子符号![]() 来表示质量数为A,质子数为z的X原子,其中质量数=质子数+中子数。如上述氕、氘、氚3种不同的氢原子就可以依次表示为
来表示质量数为A,质子数为z的X原子,其中质量数=质子数+中子数。如上述氕、氘、氚3种不同的氢原子就可以依次表示为![]() .质子数相同而中子教不同的同一元素的不同原子互称为同位素。如
.质子数相同而中子教不同的同一元素的不同原子互称为同位素。如![]() 互为同位素。同位素在生活、生产和科学研究中有着重要用途。例如考古时利用
互为同位素。同位素在生活、生产和科学研究中有着重要用途。例如考古时利用![]() 测定一些文物的年代;通过测定
测定一些文物的年代;通过测定![]() 和
和![]() ,分析古代人类的食物结构:追踪
,分析古代人类的食物结构:追踪![]() 发出的射线,确定磷在植物中的作用部位等。
发出的射线,确定磷在植物中的作用部位等。
(1)测定相对原子质量时,要使用含有6个质子和6个中子的一种碳原子质量的1/12作标准。该碳原子的原子符号为__________.
(2)在![]() 中, 互为同位素的是__________和__________.
中, 互为同位素的是__________和__________.
(3)![]() 的原子核内中子数是__________.
的原子核内中子数是__________.
(4)下列说法正确的是__________(填字母)。
A ![]() 原子的结构示意图为
原子的结构示意图为
B 氘原子与氚原子的相对原子质量不同
C 由![]() 和
和![]() 组成的1个水分子中含11个中子
组成的1个水分子中含11个中子
D 氕、氘、氚3种氢原子最多可以组成6种不同的氢分子