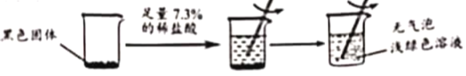
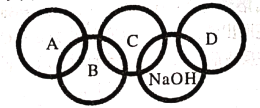【题目】某实验小组将少量氢化钙(CaH2)溶于水,形成了无色透明的溶液,再向其中加入碳酸钠溶液,有沉淀产生,经过滤后得到滤渣和滤液。然后进行了滤渣验证和滤液溶质成分的探究。
(1)(查阅资料)氢化钙在常温下能与水反应生成氢氧化钙和氢气,写出该反应的化学方程式______________。
(2)(交流验证)滤渣只能是碳酸钙,用盐酸验证此滤渣的化学方程式为______________。
(3)(提出问题)滤液中溶质的成分是什么?
(4)(猜想假设)猜想一:NaOH
猜想二:NaOH和Na2CO3
猜想三:NaOH和________。
猜想四:NaOH、Na2CO3和Ca(OH)2
(5)(讨论分析)经过讨论认为最不合理的是猜想____,原因是______________。
(6)(实验与结论)
实验步骤 | 现象 | 结论 |
步骤I:取少量滤液,向其中加入足量盐酸溶液 | ________ | 猜想二不成立 |
步骤Ⅱ:另取少量滤液,向其中滴入适量Na2CO3溶液 | 产生白色沉淀 | 猜想____成立 |
(7)(拓展延伸)在分析反应后所得物质的成分时,除考虑生成物外,还需考虑___________。
【题目】镁及其化合物在生产、生活中有着广泛的应用前景。
(一)镁及其化合物的广泛应用
(1)金属镁可以用于制造信号弹和焰火,因其燃烧时发出____
(2)工业上通过反应: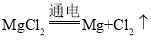 ,得到金属镁,反应中电能转化为___能
,得到金属镁,反应中电能转化为___能
(3)用不锈钢、合成橡胶、氧化镁等材料制造的飞机轮胎属于___材料。
(4)用含有Mg(OH)2的药物治疗胃酸过多,该反应的化学方程式为_________.
(5)碳酸镁可作阻燃剂,其可能的原因是____(选填序号)。
a 分解时吸热,降低可燃物的着火点
b 生成的固体覆盖燃烧物,隔绝氧气
(二)碳酸镁水合物的制备
MgCO3· 3H2O是制备镁产品的中间体。工业上从碱性卤水(主要成分为MgCl2中获取MgCO3·3H2O的方法如图1所示。
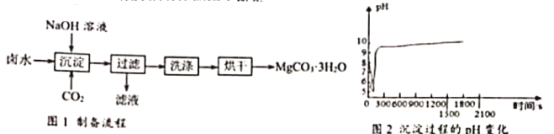
(1)“沉淀”过程的pH随时间的变化如图2所示,其操作为;向卤水中通入CO2至饱和然后滴加NaOH溶液,同时继续通入CO2,由此判断卤水的碱性比NaOH溶液_____(“强”或“弱”)。
(2)“沉淀”时生成MgCO3 ·3H2O的总反应化学方程式为_____
(3)证明沉淀已经洗涤干净的方法是:取最后一次洗涤所得滤液,先加足量稀HNO3滴加____溶液,无现象。
(三)样品成分的分析
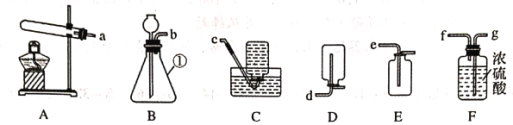
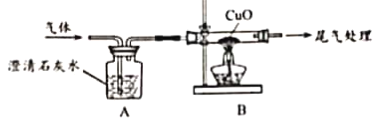
在烘干时,会有部分MgCO3·3H2O转化为碱式碳酸镁晶体Mga(OH)b(CO3)c · dH2O.为测定Mga(OH)b(CO3)c · dH2O的组成,称取18.46g固体混合物,在科研人员的指下用下图装置进行热分解实验,并记录实验数据于下表中。
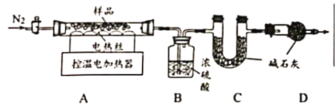
温度/℃ | 室温 | 190 | 450 |
浓硫酸 | 150.00 | 155.40 | 156.30 |
碱石灰 | 100.00 | 100.00 | 106.16 |
(资料)
①MgCO3·3H2O在190℃完全失去结晶水;MgCO3;在400℃完全分解生成两种氧化物。
②Mga(OH)b(CO3)c · dH2O在210℃以下不分解:450℃完全分解生成三种氧化物。
(1)装配好实验装置后,先要______
(2)加热前后及过程中均通入N2,停止加热后继续通N2的目的是__
(3)计算a:c=___,Mga(OH)b(CO3)c · dH2O中结晶水的质量为___g
(4)若实验中缺少D装置,则α:c的值____选填“偏大”、“偏小”或“不变”
(5)MgCO3·3H2O受热转化为碱式碳酸镁晶体Mga(OH)b(CO3)c · dH2O的化学方程式为______。