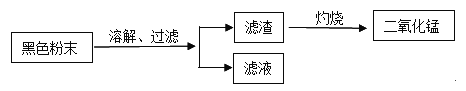
【题目】在小英家的仓库里,堆放着一袋袋碳酸氢铵(NH4HCO3)。过了一个夏天,小英发现这种化肥所特有的刺激性气味变得更浓烈了,有些化肥袋里碳酸氢铵变少了。检查发现,变少的化肥包装袋没有密封,化肥也没有撒落在地上,更没有人进过仓库开袋使用。为了探究这些化肥减少的原因,小英在实验室取了一些碳酸氢铵粉末,放在蒸发皿中加热,过一会儿观察到粉末完全消失,同时也闻到了这种刺激性气味。粉末为什么会消失呢?
[提出问题] 碳酸氢铵粉末消失的原因是什么?
[猜想]
①碳酸氢铵粉末在不加热或加热条件下由固态变成它的气态。
②碳酸氢铵在不加热或加热条件下发生分解反应,可能产生的物质有氨气和其他物质。
[查阅资料]
(1)碳酸氢铵属于氮肥,不具有升华的性质,说明上述猜想______(填序号)不成立。
(2)氨气(NH3)具有特殊的刺激性气味,极易溶于水,能使湿润的红色石蕊试纸变蓝。
(3)二氧化氮(NO2)为红棕色气体,一氧化氮(NO)为无色气体,在空气中易发生反应:![]() 。
。
[进行实验]
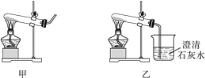
实验操作 | 实验现象 | 实验结论 |
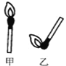
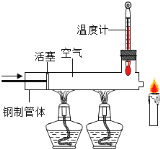
Ⅰ.取适量碳酸氢铵于试管中加热,如图7甲所示,将干燥的红色石蕊试纸接近导管口 | 产生强烈的刺激性气味,试管壁上有无色液滴且试纸变蓝,但未见红棕色气体 | 分解产物中有______和______,没有________或一氧化氮 |
Ⅱ.按图乙所示装置继续实验,直到反应完全 | 澄清石灰水变浑浊 | 分解产物中有__________ |
[应用]
(1)利用氨气的化学性质,检验一集气瓶内气体是不是氨气。
实验操作 | 实验现象 | 实验结论 |
__________________ | __________________ | 集气瓶内气体为氨气 |
(2)如果你家里有碳酸氢铵化肥,你应该如何保存?______________________。
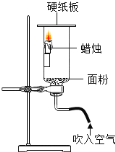
【题目】化学小组受英国科学家法拉第《蜡烛的化学史》的启发,对蜡烛的燃烧过程进行了一次探究。
[查阅资料] 硫酸铜(CuSO4)是一种白色粉末,吸水后变为蓝色。
[进行实验]
序号 | 实验步骤 | 实验现象 | 实验结论 |
Ⅰ |
| 外焰处的铁纱窗出现红热的环,内焰及焰心处的铁纱窗无明显变化 | __________ |
Ⅱ |
| 硫酸铜粉末变成______色,澄清石灰水______ | 蜡烛燃烧的产物中有水和二氧化碳 |
[反思与评价]
实验Ⅱ是该小组同学对图乙所示实验的改进。与图乙所示实验相比,实验Ⅱ的优点是_______。