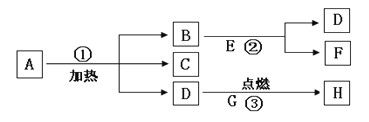
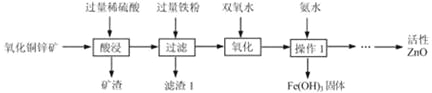
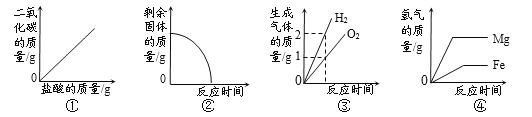
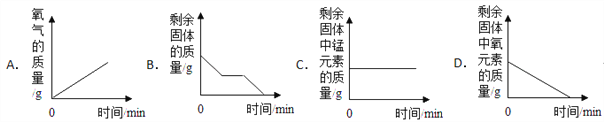
【题目】某化学兴趣小组的同学对一批铁样品(含有杂质,杂质不溶于水,也不与稀硫酸反应)进行分析,甲、乙、丙三位同学分别进行实验,其中只有一位同学所用的稀硫酸与铁样品恰好完全反应。实验数据如下表:
甲 | 乙 | 丙 | |
稀硫酸 | 150 | 120 | 120 |
铁样品 | 12 | 12 | 15 |
反应后的剩余物 | 161.6 | 131.6 | 134.6 |
(1)____同学所用的稀硫酸与铁样品恰好完全反应;共产生___ g气体。
(2)计算样品中的铁的质量分数是_____?(最后结果精确到0.1%,下同)
(3)计算恰好完全反应后所得溶液中溶质的质量分数____?
【题目】有一包白色粉末,可能由CuSO4、Na2SO4、Na2CO3、BaCl2、NaOH中的一种或几种组成.为探究其组成,同学们查阅资料得知NaCl、BaCl2溶液呈中性.他们经过思考设计并进行了以下实验

请分析实验过程,回答下列问题:
(1)白色粉末中一定不含________________。
(2)生成白色沉淀的化学方程式为___________________。
(3)为最终确定白色粉末的组成,还需要对无色滤液中呈碱性的物质进行探究。
(提出问题)无色滤液中呈碱性的物质是什么?
(做出猜想)猜想Ⅰ:Na2CO3. 猜想Ⅱ:NaOH. 猜想Ⅲ:________
(进行实验)
实验步骤 | 实验现象 | 实验结论 |
①取无色滤液少许于试管中,滴加过量的_______溶液 | 产生白色沉淀 | 猜想Ⅱ不成立. |
②在①反应后的上层清液中滴加无色酚酞试液 | 溶液变为红色 | 猜想Ⅲ成立. |
(得出结论)白色粉末的成分是_____________。