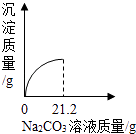
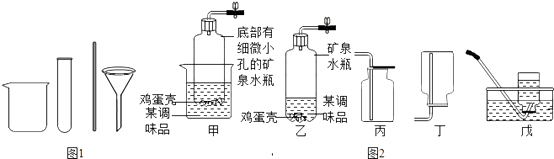
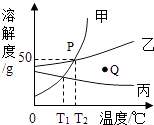
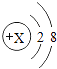0 193656 193664 193670 193674 193680 193682 193686 193692 193694 193700 193706 193710 193712 193716 193722 193724 193730 193734 193736 193740 193742 193746 193748 193750 193751 193752 193754 193755 193756 193758 193760 193764 193766 193770 193772 193776 193782 193784 193790 193794 193796 193800 193806 193812 193814 193820 193824 193826 193832 193836 193842 193850 211419