【题目】(7分)学过金属活动性后,秦思同学通过实验探究锌粉与硝酸亚铁和硝酸银两种盐溶液的反应。实验现象和数据如下:
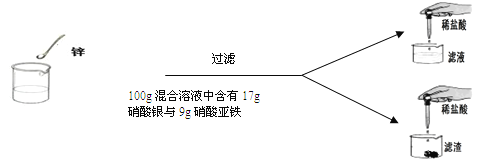
第一次 | 第二次 | 第三次 | 第四次 | |
硝酸亚铁与硝酸银的混合溶液 | 100g | 100g | 100g | 100g |
锌粉 | 2g | 3.25g | m | 9.75g |
向滤液中加入稀盐酸后的实验现象 | 产生白色沉淀 | 无明显现象 | 无明显现象 | 无明显现象 |
向滤渣中加入100 g稀盐酸后的实验现象 | 无明显现象 | 无明显现象 | 产生气泡,溶液变为浅绿色 | 现象与第三次相同 |
(1)第四次向滤渣中加入稀盐酸后产生气泡的化学方程式为 ;
(2)根据第一次的实验现象,你认为此次滤液中的溶质是 ;
(3)根据已知条件列出求解第二次实验中置换出金属银的质量(x)的比例式 ;
(4)若第三次实验锌与两种盐溶液恰好完全反应,则m的质量为__________________;
(5)若向第三次反应后的滤液中加入一定质量的水,所得不饱和溶液中溶质的质量分数为10%,则加入水的质量为__________________;
(6)若用溶质质量分数为36.5%的浓盐酸配制第四次实验中与滤渣恰好完全反应所需的稀盐酸,则需要浓盐酸与水的质量比为_______________。