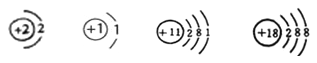题目内容
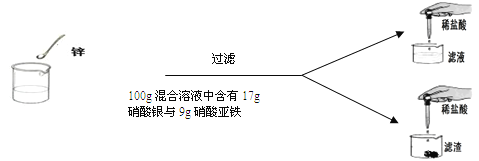
【题目】(7分)学过金属活动性后,秦思同学通过实验探究锌粉与硝酸亚铁和硝酸银两种盐溶液的反应。实验现象和数据如下:
第一次 | 第二次 | 第三次 | 第四次 | |
硝酸亚铁与硝酸银的混合溶液 | 100g | 100g | 100g | 100g |
锌粉 | 2g | 3.25g | m | 9.75g |
向滤液中加入稀盐酸后的实验现象 | 产生白色沉淀 | 无明显现象 | 无明显现象 | 无明显现象 |
向滤渣中加入100 g稀盐酸后的实验现象 | 无明显现象 | 无明显现象 | 产生气泡,溶液变为浅绿色 | 现象与第三次相同 |
(1)第四次向滤渣中加入稀盐酸后产生气泡的化学方程式为 ;
(2)根据第一次的实验现象,你认为此次滤液中的溶质是 ;
(3)根据已知条件列出求解第二次实验中置换出金属银的质量(x)的比例式 ;
(4)若第三次实验锌与两种盐溶液恰好完全反应,则m的质量为__________________;
(5)若向第三次反应后的滤液中加入一定质量的水,所得不饱和溶液中溶质的质量分数为10%,则加入水的质量为__________________;
(6)若用溶质质量分数为36.5%的浓盐酸配制第四次实验中与滤渣恰好完全反应所需的稀盐酸,则需要浓盐酸与水的质量比为_______________。
【答案】(1)Fe +2HCl=== FeCl2 + H2↑ 和Zn +2HCl=== ZnCl2 +H2↑
(2)硝酸银、硝酸锌、硝酸亚铁(或AgNO3、Zn(NO3)2、Fe(NO3)2)
(3)340:216=17g:x (或65:216=3.25g:x) (4)6.5g (5)96.1g (6)1:4
【解析】
试题分析:(1)根据金属的活动性:Zn、Fe、Ag,所以硝酸亚铁和硝酸银两种盐溶液中加入锌粉,发生反应的先后顺序:2AgNO3+Zn== Zn (NO3)2+2Ag,Fe(NO3)2+Zn== Zn (NO3)2+ Fe ,反应发生的程度完全取决于锌的量,根据前三次的实验现象,所以第四次向滤渣中加入稀盐酸后产生气泡的化学方程式为:Fe +2HCl=== FeCl2 + H2↑ 和Zn +2HCl=== ZnCl2 + H2↑
(2) 根据第一次的实验现象,在滤液中加入盐酸,有白色沉淀生成,说明第一个反应:2AgNO3+Zn== Zn (NO3)2+2Ag都没有完全发生,所以滤液中的溶质是:硝酸银、硝酸锌、硝酸亚铁
(3) 根据第二次的实验现象,在滤液中加入盐酸,没有白色沉淀生成,说明溶液中没有AgNO3,而在滤渣中加入盐酸无气体,说明第一个反应恰好反应完全,所以根据方程式:2AgNO3+Zn== Zn (NO3)2+2Ag中AgNO3和Ag的质量关系340:216,所以可列式:340:216=17g:x,也可以根据方程式中Zn和Ag的质量关系65:216,所以可列式:65:216=3.25g:x,
(4) 因为第二次实验表明AgNO3恰好完全,若第三次实验锌与两种盐溶液恰好完全反应,则表明第三次实验就是锌与9g硝酸亚铁反应,根据方程式:Fe(NO3)2+Zn== Zn (NO3)2+ Fe中Fe(NO3)2和Zn的质量关系180:65,而硝酸亚铁为9g,所以消耗Zn的质量为3.25g,故m的质量为=3.25g+3.25g=6.5g
(5)根据上面的分析第三次实验恰好2个反应完全发生,得到的是Zn (NO3)2溶液,反应消耗Zn的质量为6.5g,Zn (NO3)2得到的质量=6.5g÷65/189×100%=18.9g,由于加入的6.5g锌生成铁的的质量为2.8g,生成银的质量为10.8g,所以溶液的质量=100g+6.5g-2.8g-10.8g=92.9g,再抓住稀释过程中溶质的质量不变,可设加入水的质量为x,可列式为:18.9g=(92.9g+x)×10%,x=96.1g
(6)根据上面的分析,第四次滤渣中应含2.8g铁,以及过量的锌质量=9.75g-6.5g=3.25g 再根据反应Fe +2HCl=== FeCl2 + H2↑ 和Zn +2HCl=== ZnCl2 +H2↑,即可算出100g盐酸中所含的氯化氢质量为7.3g,即盐酸的质量分数为7.3g/100g×100%=7.3%,所以若用溶质质量分数为36.5%的浓盐酸配制这样的稀盐酸,需要浓盐酸与水的质量比为1:4

【题目】(8分)常温下没有氧气存在时,铁与水几乎不反应,但高温下,铁与水蒸气能反应生成一种常见铁的氧化物和一种气体。小明很好奇,设计如下实验探究铁粉与水蒸气反应后的产物。
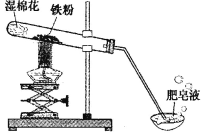
(1)试管尾部放一团湿棉花的目的是_______________。
(2)探究生成的气体是什么?
用燃着的木条靠近肥皂泡,有爆鸣声,稍后有肥皂泡飘到空中。 说明生成的气体是______________。
(3)探究试管中剩余固体成分是什么?
【查阅资料】
常见铁的氧化物 | FeO | Fe2O3 | Fe3O4 |
颜色、状态 | 黑色粉末 | 红棕色粉末 | 黑色晶体 |
能否被磁铁吸引 | 否 | 否 | 能 |
【初步验证】试管中剩余固体为黑色,能全部被磁铁吸引。
【猜想与假设】猜想一:剩余固体是Fe与Fe3O4;猜想二:剩余固体是_____________。
【实验探究】
实验操作 | 实验现象及结论 |
【实验结论】铁和水蒸气反应的化学方程式为___________________________________。
【反思与交流】该黑色固体不可能是Fe2O3,理由是_______________________________。