【题目】(18分)硫酸亚铁铵晶体俗名为摩尔盐,化学式为xFeSO4·y(NH4)2SO4·zH2O,在制药、电镀方面有广泛的应用。
资料: ①硫酸亚铁铵晶体易溶于水,不溶于乙醇;
②相关物质的溶解度(单位:g)如下表:
温度/℃ | FeSO4 | (NH4) 2SO4 | xFeSO4·y(NH4)2SO4·zH2O |
10 | 20.0 | 73 | 17.2 |
20 | 26.5 | 75.4 | 21. 6 |
30 | 32.9 | 78 | 28.1 |
③硫酸亚铁铵晶体受热时,在200℃以下只有结晶水失去。
【探究一】:制备硫酸亚铁铵晶体
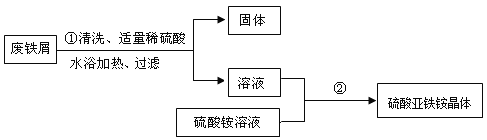
某兴趣小组的学生用含有少量铜的废铁屑制备硫酸亚铁铵晶体,流程如下:
(1)在盛有废铁屑的容器中,倒入热水和洗涤剂,充分搅拌。以除去废铁屑表面的油污,这是利用洗涤剂的 作用;
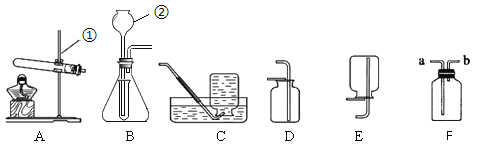
(2)操作①中发生反应的化学方程式为 ;
(3)过滤所需的玻璃仪器有烧杯、玻璃棒、 。过滤操作中滤纸有多种折法,为了加快过滤速率,你选择折法是 ;
(4)操作①中过滤时,要趁热进行的原因是 ,过滤后得到的固体中一定含有的物质是 ;
(5)操作②的目的是得到硫酸亚铁铵晶体。操作顺序是b→ → →d;
a.过滤 b.加热浓缩 c.冷却结晶 d.洗涤干燥
(6)操作②中使用乙醇洗涤,可快速晾干。这样做的优点是 ;
A、避免用水洗涤所造成的晶体损耗
B、酒精易挥发,可低温晾干晶体
【探究二】:探究硫酸亚铁铵的组成
【实验步骤】:取2份等质量的硫酸亚铁铵晶体,分别进行实验。向一份中加入过量的NaOH溶液,充分反应后得到0.68gNH3;向另一份中加入过量的BaCl2溶液,充分反应后过滤、洗涤、干燥得到9.32g沉淀。
回答下列问题:
(7)实验中生成的NH3能使湿润的 变蓝;写出(NH4)2SO4与NaOH反应的化学方程式 ,属于 反应;
(8)实验中加入过量BaCl2溶液的目的 ;
(9)取最后一次洗涤液,加入Na2SO4溶液, ,则说明沉淀已经洗涤干净;
(10)根据实验数据,计算x 和y的比值(2分,写出计算过程;相对分子质量:NH3-17、BaSO4-233)
;
为进一步确定硫酸亚铁铵晶体的组成,另取7.84g硫酸亚铁铵晶体,并加热使其分解,剩余固体质量与温度的关系如图所示。则:
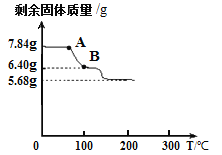
(11)根据图示数据,硫酸亚铁铵晶体中,
x:y:z = ;
(12)写出A点到B点发生反应的化学方
程式 /span>。