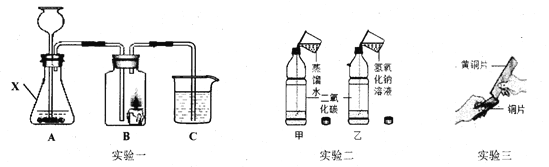
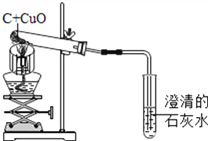
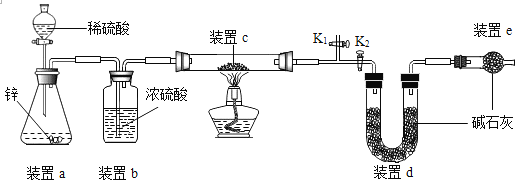
0 192829 192837 192843 192847 192853 192855 192859 192865 192867 192873 192879 192883 192885 192889 192895 192897 192903 192907 192909 192913 192915 192919 192921 192923 192924 192925 192927 192928 192929 192931 192933 192937 192939 192943 192945 192949 192955 192957 192963 192967 192969 192973 192979 192985 192987 192993 192997 192999 193005 193009 193015 193023 211419