【题目】草酸镍晶体(NiC2O4·2H2O)可用于制镍催化剂。某小组用废镍催化剂(成分为Fe2O3、Ni、Fe、SiO2等)制备草酸镍晶体的部分实验流程如下:

已知:①Ni能和稀H2SO4反应。
②相关金属离子生成氢氧化物沉淀的pH如下表:
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.1 | 3.2 |
Fe2+ | 5.8 | 8.8 |
Ni2+ | 6.7 | 9.5 |
③H2O2能将Fe2+氧化为Fe3+
(1)废镍催化剂“粉碎”的目的是______。
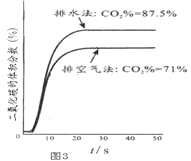
(2)保持其他条件相同,在不同温度下对废镍催化剂进行“酸浸”,镍浸出率随时间变化如图,“酸浸”的适宜温度与时间分别为 _______(填字母)。
A.30℃、30min B.90℃、150min C.70℃、120min D.90℃、120min

(3)“酸浸”中发生的复分解反应方程式为________。
(4)“浸出液”得到“溶液x”过程中,加入试剂先后顺序是_____(填字母)。
A.先加H2O2溶液,再加NaOH溶液 B.先加NaOH溶液,再加H2O2溶液
加NaOH溶液调节pH_____(填范围),充分反应后得到滤渣的操作是______,该操作中所用到的玻璃仪器有玻璃棒、烧杯和_________。
(5)将“沉镍”工序:①主要过程为:蒸发浓缩、_____ 、过滤,所得固体用75%乙醇洗涤、110℃下烘干,得草酸镍晶体。
②用75%乙醇洗涤的目的是洗去杂质、___________;
③烘干温度不超过110℃的原因是______。
【题目】下列依据实验目的所设计的实验方案中,正确的是( )
选项 | 实验目的 | 实验方案 |
A | 除去NaCl溶液中的Na2CO3 | 加适量稀硫酸 |
B | 除去CaO中的CaCO3 | 加水溶解,过滤 |
C | 除去CO2中的HCl气体 | 将混合气体通入NaOH溶液 |
D | 除去KNO3溶液中的KCl | 加适量的AgNO3溶液,过滤 |
A. A B. B C. C D. D