【题目】据统计,我国每年报废的手机超过1亿部,若不进行回收利用,会造成巨大的浪费和污染。同学们对废旧手机中的金属回收产生兴趣。
【提出问题】 从废旧手机中可以回收到哪些有价值的金属?如何回收?
【查阅资料】
Ⅰ.手机电路板中的金属及其价格如下表所示:
种类 | Fe | Cu | Al | Ni | Au | Ag | Pd(钯) |
市场价格/($/t) | 3 6 5 | 7175.5 | 1710.5 | 1 4 2 3 5 | 4.7×107 | 7.6×105 | 2 . 7 × 1 0 7 |
矿石中含量 | 72.4 | 0.87 | 29.1 | 1.02 | 4 | 120 | 0.4 |
手机电路板中含量 | 5 | 13 | 1 | 0.1 | 350 | 1380 | 210 |
说明:Fe、Cu、Al、Ni的含量用质量分数(%)表示,Au、Ag、Pd的含量的单位为“g/t”。
Ⅱ.Ni的金属活动性位于氢前;Pd的金属活动性位于氢后; NiCl2溶液为绿色。
Ⅲ.2Cu + O2 + 2H2SO4 ![]() 2CuSO4 + 2H2O
2CuSO4 + 2H2O
【实验方案】
第一步:选择值得回收的金属
依据资料Ⅰ中的数据,废旧手机中有回收价值的金属有Au、Ag、Cu、Pd,原因是:
① _____________;②它们的市场价格较高。
第二步:设计实验分离、回收部分金属
实验步骤 | 实验现象 | |
I | 取一废旧手机电路板,用电吹风机靠近电路焊接点的焊锡吹热风,一段时间后,用镊子将金属电路从塑料板中拽出 | 焊锡熔化 |
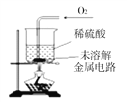
II | 将金属电路放入烧杯中,加入过量稀盐酸浸泡 | …… |
III | 取II中未溶解的金属电路,用蒸馏水洗净后,放入如图所示装置中,进行实验。 | 溶液逐渐变成蓝色,仍有微量金属固体未溶解 |
IV | 过滤III中烧杯中的物质,洗涤滤纸上的物质 | 滤纸上仍有微量金属固体 |
V | …… | …… |
【问题讨论】
(1)由步骤I中的现象,可推知的焊锡的物理性质是____________。
(2)步骤II对应的实验现象有___________。
(3)步骤II所得溶液中,至少含有溶质有_____________种。
(4)步骤V的操作是:“向步骤Ⅳ获得滤液中加入一定量铁粉”,若该实验过程加入铁粉前后溶液中主要离子变化示意图如下图所示:
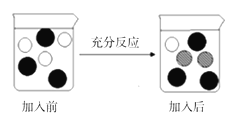
① 图中“![]() ”所代表微粒的符号为____________;
”所代表微粒的符号为____________;
② 充分反应后过滤,滤纸上固体物质是____________(写化学式)。
【题目】某兴趣小组同学准备进行常见酸、碱、盐性质实验时,发现实验台上有一瓶失去瓶塞并且标签破损的液体药品(如图),于是决定对这瓶溶液的成分进行实验探究:
【提出问题】这瓶溶液是什么溶液?
【获得信息】酸、碱、盐的性质实验中用到含钠元素的物质是氯化钠、氢氧化钠、碳酸钠。
【提出猜想】这瓶溶液可能是:
①氯化钠溶液; ②氢氧化钠溶液; ③碳酸钠溶液。
【实验推断】
实验 | 实验操作 | 实验现象 | 实验结论和解释 |
(1) | 取样于试管中,滴加无色酚酞试液。 | 溶液呈红色 | 该溶液不可能是___________溶液, 理由是____________。 |
(2) | 另取样于试管中,滴加足量稀盐酸。 | _________ | 该溶液为碳酸钠溶液 |
(3)小青认为上述实验(2)的结论不完全正确,小组同学讨论后一致认为还需要进行如下实验:另取样于试管中,加入过量的中性CaCl2溶液,观察到有白色沉淀产生,设计这一步骤的目的是_______________;静置后,取上层清液,滴入酚酞试液,溶液呈红色。
【实验结论】这瓶溶液原来是____________。