某固体混合物可能含有BaCl2、FeCl3、Mg(NO3)2、Na2SO4、CaCO3中的一种或几种,为确定其组成,兴趣小组进行如下探究,请你参与解答相关问题。
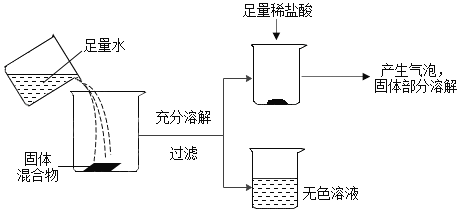
(1)分析图可知,固体混合物中不含有的物质是________。加入水后发生反应的化学方程式为____________
(提出问题)过滤所得无色溶液中含有哪些溶质?
(猜想与假设)猜想无色溶液中所含溶质可能为
猜想I: NaCl、Mg(NO3)2;
猜想II: NaCl、BaCl2;
猜想III: NaCl、Na2SO4;
猜想IV: NaCl、Mg(NO3)2、______
猜想V:含有NaCl、Mg(NO3)2、BaCl2。
(实验探究)
实验操作 | 实验现象 |
①取少量无色溶液于试管中,向其中滴加氢氧化钡溶液 | 产生白色沉淀 |
②在①反应后的试管中,加入足量的稀盐酸 | 白色沉淀部分溶解 |
(结论和反思)
(2)根据探究结果可知,猜想______成立, 步骤②沉淀溶解的化学方程式为_________
(3)若步骤②的现象为“白色沉淀全部溶解”,则该实验探究及步骤设计存在不足,因为这种情况下无法判断猜想_____和猜想_____哪个成立。
铁粉中混入了少量的某种盐杂质,为测定混合物中铁粉的质量分数,某小组进行了如下操作:称取7.7g混合物,然后将80 g稀硫酸分四次加入盛装混合物的容器中,测得加入稀硫酸的质量与生成氢气的质量关系如下表。( 盐杂质不与单质铁反应)
第一次 | 第二次 | 第三次 | 第四次 | |
加入稀硫酸的质量/ g | 20 | 20 | 20 | 20 |
产生氢气的累计质量/g | 0.05 | 0.15 | 0.20 | m |
(1)表中m的值为______;第三次加入的硫酸________(填“被”或“未被")反应完。
(2)计算混合物中铁粉的质量分数是多少?(写出计算过程,结果精确到0.1%)
(3)请根据数据和计算结果,在坐标中画出对应的曲线。
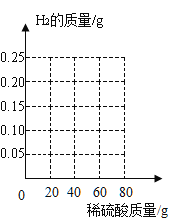
(4)第一次加入稀硫酸时,产生的氢气只有0.05g 的原因可能是________
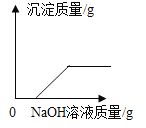
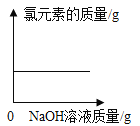
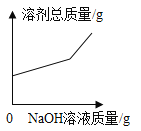
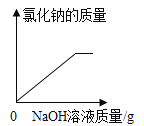

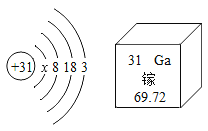
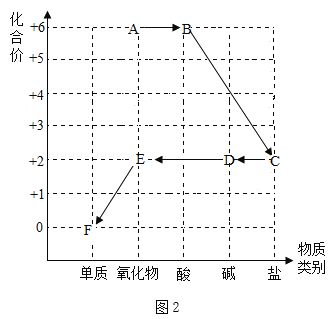
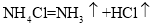

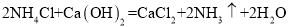
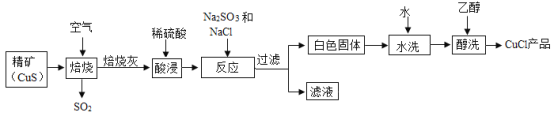
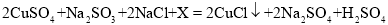 ,则X的化学式是__; 加入NaCl时要控制它的用量,以防止氯离子浓度过大而造成_____.
,则X的化学式是__; 加入NaCl时要控制它的用量,以防止氯离子浓度过大而造成_____.