题目内容
【题目】自来水厂常用氯气杀菌消毒,用明矾、氯化铁等净化水。以硫铁矿(主要成分是FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的流程如图:
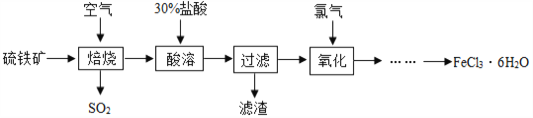
(1)已知“焙烧”阶段就是硫铁矿的燃烧,生成物是Fe2O3和SO2,写出该反应的化学方程式 _________________,硫铁矿进行燃烧前要将其粉碎,其目的是____________。
(2)大量排放出的SO2能形成_________,危害环境,可将含SO2的废气通入氨水中,氨水的pH______7,反应后生成的亚硫酸铵[(NH4)2SO3]在农业上可做__________肥。
(3)①流程中用30%盐酸“酸溶”焙烧后的残渣,写出化学方程式_________;
②在“酸溶”时是否可以用硫酸代替盐酸?________(填“可以”或“不可以”),原因是____;
③若在实验室欲用38%(密度为1.18 g/ml)的盐酸配制30%的盐酸,则需要的玻璃仪器有烧杯、胶头滴管、________、________等。
(4)实际上“焙烧”阶段很难做到将硫铁矿完全反应,因“酸溶”后的混合物中有FeCl2,将其在“氧化”阶段与氯气(Cl2)反应生成FeCl3,写出化学方程式__________________。
【答案】 4 FeS2 + 11 O2 点燃 2 Fe2O3 + 8 SO2 加快反应速率,使反应更充分 酸雨 > 氮 Fe2O3 + 6 HCl = 2 FeCl3 + 3 H2O 不可以 反应后不能生成FeCl3 玻璃棒 量筒 2 FeCl2 + Cl2 = 2 FeCl3
【解析】(1)根据题中的叙述找出反应物、生成物以及反应条件,然后依据质量守恒定律书写化学方程式;根据增大反应物的接触面积可以加快反应速率进行分析;(2)根据大量排放出的SO2能形成酸雨,氨水是一种常见的碱分析,根据硫酸铵含有氮元素分析;(3)①根据氧化铁与盐酸的反应写出反应的化学方程式;②根据硫酸和氧化铁反应会生成硫酸铁进行分析;③根据实验室配制一定溶质质量分数的溶液解答;(4)根据题中的反应原理找出反应物、生成物以及反应条件,然后依据质量守恒定律书写化学方程式。(1)硫铁矿和氧气在点燃的条件下生成氧化铁和二氧化硫,化学方程式为4FeS2+11O2![]() 2Fe2O3+8SO2;增大反应物的接触面积可以加快反应速率,所以硫铁矿进行燃烧之前要将其粉碎,增大了反应物的接触面积,其目的是:加快反应速率,使反应更充分;(2)大量排放出的SO2能形成酸雨,氨水是一种常见的碱,氨水的pH>7,反应后生成的亚硫酸铵[(NH4)2SO3](含有氮元素)在农业上可做氮肥;(3)流程中需用30%的盐酸“酸溶”焙烧后的残渣,盐酸和氧化铁反应生成氯化铁和水,化学方程式为Fe2O3+6HCl═2FeCl3+3H2O,“酸溶”时可改用硫酸,硫酸和氧化铁反应生成硫酸铁和水,而题中需要制备氯化铁晶体,所以不能改用硫酸,原因是反应后不能生成FeCl3;(4)通过分析题中的反应原理,酸溶后的混合物中通入氯气制取氯化铁,氯气和氯化亚铁反应生成氯化铁,化学方程式为2FeCl2+Cl2═2FeCl3。
2Fe2O3+8SO2;增大反应物的接触面积可以加快反应速率,所以硫铁矿进行燃烧之前要将其粉碎,增大了反应物的接触面积,其目的是:加快反应速率,使反应更充分;(2)大量排放出的SO2能形成酸雨,氨水是一种常见的碱,氨水的pH>7,反应后生成的亚硫酸铵[(NH4)2SO3](含有氮元素)在农业上可做氮肥;(3)流程中需用30%的盐酸“酸溶”焙烧后的残渣,盐酸和氧化铁反应生成氯化铁和水,化学方程式为Fe2O3+6HCl═2FeCl3+3H2O,“酸溶”时可改用硫酸,硫酸和氧化铁反应生成硫酸铁和水,而题中需要制备氯化铁晶体,所以不能改用硫酸,原因是反应后不能生成FeCl3;(4)通过分析题中的反应原理,酸溶后的混合物中通入氯气制取氯化铁,氯气和氯化亚铁反应生成氯化铁,化学方程式为2FeCl2+Cl2═2FeCl3。

【题目】在一密闭容器中,有X、O2、CO2、H2O四种物质,在一定条件下发生某种反应,反应一段时间后,测得反应前后各物质的质且如下表.下列说法正确的是
物质 | X | O2 | CO2 | H20 |
反应前的质量/g | 19 | 34 | 6 | 2 |
反应后的质量/g | 11 | 待侧 | 28 | 20 |
A. 表中的待测值为32 B. X中一定含有C、H、O元素
C. 该反应是置换反应 D. 反应中CO2和H2O的质量比为11:9