题目内容
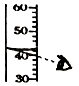
【题目】甲、乙两种物质的溶解度曲线如图所示,回答下列问题. 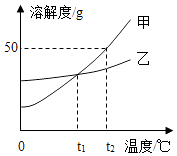
(1)t2℃时,甲乙两种物质的饱和溶液溶质质量分数大小关系为甲乙(填<、>或=).
(2)甲中混有少量乙,要提出得到甲最好采用(填蒸发溶剂或冷却热饱和溶液).
(3)℃时,甲乙两物质的溶解度相等.
(4)t2℃时,把40g甲放入50g水中充分搅拌溶解后得到的溶液质量为g,该溶液为(填饱和或不饱和).
【答案】
(1)>
(2)冷却热饱和溶液
(3)t1
(4)75;饱和
【解析】解:(1)t2℃时,甲物质的溶解度大于乙物质的溶解度,所以甲、乙两种物质的饱和溶液溶质质量分数大小关系为甲>乙;(2)甲物质的溶解度受温度变化影响较大,所以甲中混有少量乙,要提纯得到甲最好采用冷却热饱和溶液;(3)通过分析溶解度曲线可知,t1℃时,甲乙两物质的溶解度相等;(4)t2℃时,甲物质的溶解度是50g,所以把40g甲放入50g水中充分搅拌溶解后得到的溶液质量为75g,该溶液为饱和溶液.所以答案是:(1)>;(2)冷却热饱和溶液;(3)t1;(4)75,饱和.
【考点精析】通过灵活运用结晶的原理、方法及其应用和固体溶解度曲线及其作用,掌握结晶的两种方法:蒸发溶剂,如NaCl(海水晒盐)和降低温度(冷却热的饱和溶液,如KNO3);1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和)即可以解答此题.

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案【题目】有一包白色固体,可能含有氯化钠、氢氧化钠、碳酸钠、硫酸钠和硝酸钡中的一种或几种,为探究其组成,某学习小组设计方案并进行了如下实验: 
(1)小郁同学通过上述实验推知:白色固体样品中一定不含有 .
(2)为确定白色固体样品中可能存在的物质,小强对沉淀C进行实验.
实验操作 | 现象 | 结论 |
取少量沉淀C于试管中,加入过量稀硝酸 | 白色固体样品中一定含有碳酸钠 |
(3)小虎同学认为白色固体中还有物质不能确认其是否存在,其理由是(用化学方程式表示): , 如要确认,只需将上述实验方案中所加的一种试剂改为即可.