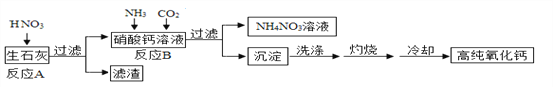
��Ŀ����
����Ŀ��ij�о���ѧϰС�����ⶨʯ��ʯ��̼��Ƶ��������������õķ������£�ȡ��ʯ��ʯ��Ʒ5g���� 60gϡ������Ĵμ��룬ʵ����������������±�����֪ʯ��ʯ��Ʒ�к��е����� ������ˮ��Ҳ����ϡ���ᷴӦ��������ʵ�����ݼ��㣺
ʵ����� | 1 | 2 | 3 | 4 |
����ϡ���������/g | 15 | 15 | 15 | 15 |
ʣ����������/g | 3.50 | 2.00 | 0.75 | 0.75 |
��1��ʯ��ʯ��Ʒ��̼��Ƶ���������Ϊ_____��
��2����ԭ 60g ϡ��������������������Ҫ����д������̣�__________��
���𰸡� 85%���� 7.3%��
��������
��1���������ݿ�֪����������������ʱӦ��Ϊʣ������ʣ�����̼��Ƶ�����Ϊ5g��0.75g=4.25g��ʯ��ʯ��Ʒ��̼��Ƶ���������Ϊ![]() ��100%=85%��
��100%=85%��
��2�����ݵ�һ�μ���15gϡ���ᵼ�¹������5g��3.50g=1.50g��
��ԭϡ������������������Ϊx��
CaCO3+2HCl�TCaCl2+H2O+CO2��
100 73
1.50g 15gx
![]() =
=![]()
x=7.3%
�𣺣�1��ʯ��ʯ��Ʒ��̼��Ƶ���������Ϊ 85%��
��2��ԭ 60g ϡ������������������Ϊ7.3%��

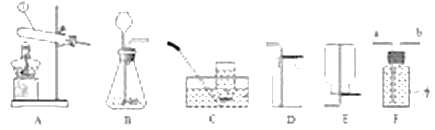
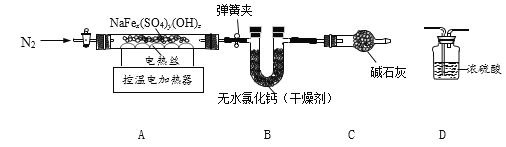
����Ŀ��ij��ѧ�С����һ��ʵ���н�������ͼ��ʾʵ��:
��ʱ˫�쵽U��������������ĬF��քe��__________��ʵ���,С�Mͬѧ�����U��,���ֹ������а�ɫ�������,���������˺�,ͬѧ�Ƕ���Һ�ɷֲ�����Ũ�����Ȥ,���ǽ����˽�һ�i��̽�����

[������}]:��Һ�п��ܺ�����Щ����?
[���������]:����һ:����ΪNaC1
�����:����ΪNaC1��![]()
������:����ΪNaC1��![]() �� HCl
�� HCl
[�����뽻��]:����Ϊ���ϲ���_________��������������_______________��
����IJ���Ϊ_______________��
[ʵ��̽��]:С��Ϊ����֤��Һ�ɷ֣�ȡ��Һ���Թ��У������еμ���������������Һ���۲쵽�����������ɴ˵ó�����:����һ������С����ΪС��Ľ��۲����ܣ���Ϊ_____��
Ϊ��֤��IJ�������д�±�:
ʵ����� | ʵ������ | ʵ����� |
________ | ________ | ��IJ������ |
(�������ܽ�]:ͨ������ʵ�������ܹ��ܽ��:��ȷ����ѧ��Ӧ��������Һ�����ʳɷ�ʱ�����˿����������⣬��Ҫ����________��