题目内容
【题目】某大理石样品(所含杂质不溶于水且不与酸反应)与足量的盐酸充分反应,过滤后将滤液蒸干,冷却后称量所得氯化钙固体,相关实验数据如下图所示(不计损耗):
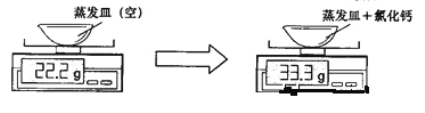
(1) 氯化钙的质量为______________g,物质的质量为 mol.
(2) 计算该大理石样品中碳酸钙的物质的量(根据化学方程式列式计算)。
【答案】(1)11.1 0.1mol (2)0.1mol
【解析】
试题分析:(1)碳酸钙与稀盐酸反应生成氯化钙、水和二氧化碳。根据图示可知,生成的氯化钙的质量=33.3g-22.2g=11.1g ;氯化钙的摩尔质量=40+35.5×2=111g/mol ;
氯化钙的物质的量=11.1g÷111g/mol=0.1mol ;
(2) 根据化学方程式,利用反应的物质的量之比即可计算出碳酸钙的物质的量。
设碳酸钙的物质的量为x ;
CaCO3+2HCl==CaCl2+H2O+CO2↑
1 1
X 0.1mol
1/1 =x/0.1mol
X=0.1mol

 手拉手全优练考卷系列答案
手拉手全优练考卷系列答案【题目】在实验探究课上,老师给了同学们一包红色粉未,该粉末是铜粉和氧化铁粉中的一种或两种.同学们为了确定该粉末的成分,进行如下探究.请你参与探究并回答问题.
【提出猜想】假设l:红色粉末是铜粉; 假设2:红色粉末是氧化铁粉;
假设3:红色粉末是 .
【实验探究】某同学为进一步确定红色粉末的组成,称取该粉末5.0g装入硬质玻璃管中,按下图装置在通风橱中进行实验.开始时缓缓通入CO气体,过一段时间后再加热使其充分反应.待反应完全后,停止加热,仍继续通CO气体直至玻璃管冷却.反应前后称量相关装置和物质的总质量,其数据如下表:
反应前 | 反应后 | |
Ⅰ 组 | 玻璃管和红色粉末的总质量为37.3g | 玻璃管和固体物质的总质量为36.1g |
Ⅱ 组 | 洗气瓶和所盛溶液 的总质量为180.0g | 洗气瓶和瓶中物质 的总质量为183.1g |
【交流讨论】
(1)应该选择 组的实验数据来计算确定组成,不选择另一组的理由是 .最终计算结果表明:该红色粉末的组成是假设 (填序号)成立.
(2)写出A装置中发生反应的化学方程式 ;实验中观察到A装置中的现象为 .
(3)为了防止溶液倒吸,本实验停止加热前是否需要先断开A和B的连接处?请判断并说明理由: .
【反思评价】
(1)从环保角度,该装置有严重不足之处.你认为应该如何改进? .
(2)实验开始时要先通入CO,把装置中的空气排尽后再加热,以防发生爆炸.检验装置中的空气已排尽的方法是 .


