题目内容
水滑石化学式为:[Mg6Al2(OH)16CO3]?4H2O(相对分子质量为602),是环保型阻燃剂,它受热时生成4种不同的氧化物,请写出该物质分解的化学方程式: 。在医药上,水滑石还能作为抗酸药,作用于胃和十二指肠溃疡等,某研究型学习小组要测定一种市售的水滑石药片中水滑石的质量分数。
[查阅资料]水滑石与稀硫酸反应的化学方程式为:[Mg6Al2(OH)16CO3]?4H2O+9H2SO4=6MgSO4+Al2(SO4)3+CO2↑+21H2O,药片中除了水滑石外含有一定量的辅料﹣﹣淀粉等物质。
[提出猜想]小华想将该药片放在空气中充分灼烧完成测定;小明想通过水滑石与硫酸反应原理来完成测定,请你参与探究。
[设计方案]他们设计了不同的实验方案。
小华的方案,称取10.0g市售的水滑石药片研磨成粉末置于通风橱中,充分灼烧至质量不再减少,再称量剩余固体的质量为6.1g,减少的质量即为二氧化碳和水的总质量,则可求的水滑石药片中水滑石的质量分数为 %。
小明的方案:

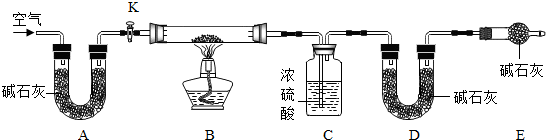
(1)小明设计了如图所示的实验装置.取10.0g市售的水滑石药片研磨成粉末,进行实验。
[说明]碱石灰是氧化钙和氢氧化钠固体的混合物,B装置中发生的化学方程式为 。
(2)操作步骤
①连接好装置,检查装置的气密性②打开弹簧夹C,在A处缓缓通入一段时间的空气③称量F的质量④关闭弹簧夹C,慢慢滴加稀硫酸至过量,直至D中无气泡冒出⑤打开弹簧夹C,再次缓缓通入一段时间空气⑥再次称量F的质量,得前后两次质量差为0.44g。
(3)问题探究
B、E装置的作用分别是 、 。若没有G装置,则测定的水滑石的质量分数会 (填“偏大”、“偏小”、“不变”)。实验选用稀硫酸而不选用稀盐酸的理由是 。
(4)数据计算
根据实验数据,可求得水滑石药片中水滑石的质量分数为 %.(写出计算过程)。
[方案评价]在上述实验方案中,你认为合理的实验方案是 (填小华或小明),另一个方案不合理的原因是 。
[查阅资料]水滑石与稀硫酸反应的化学方程式为:[Mg6Al2(OH)16CO3]?4H2O+9H2SO4=6MgSO4+Al2(SO4)3+CO2↑+21H2O,药片中除了水滑石外含有一定量的辅料﹣﹣淀粉等物质。
[提出猜想]小华想将该药片放在空气中充分灼烧完成测定;小明想通过水滑石与硫酸反应原理来完成测定,请你参与探究。
[设计方案]他们设计了不同的实验方案。
小华的方案,称取10.0g市售的水滑石药片研磨成粉末置于通风橱中,充分灼烧至质量不再减少,再称量剩余固体的质量为6.1g,减少的质量即为二氧化碳和水的总质量,则可求的水滑石药片中水滑石的质量分数为 %。
小明的方案:

(1)小明设计了如图所示的实验装置.取10.0g市售的水滑石药片研磨成粉末,进行实验。
[说明]碱石灰是氧化钙和氢氧化钠固体的混合物,B装置中发生的化学方程式为 。
(2)操作步骤
①连接好装置,检查装置的气密性②打开弹簧夹C,在A处缓缓通入一段时间的空气③称量F的质量④关闭弹簧夹C,慢慢滴加稀硫酸至过量,直至D中无气泡冒出⑤打开弹簧夹C,再次缓缓通入一段时间空气⑥再次称量F的质量,得前后两次质量差为0.44g。
(3)问题探究
B、E装置的作用分别是 、 。若没有G装置,则测定的水滑石的质量分数会 (填“偏大”、“偏小”、“不变”)。实验选用稀硫酸而不选用稀盐酸的理由是 。
(4)数据计算
根据实验数据,可求得水滑石药片中水滑石的质量分数为 %.(写出计算过程)。
[方案评价]在上述实验方案中,你认为合理的实验方案是 (填小华或小明),另一个方案不合理的原因是 。
[Mg6Al2(OH)16CO3]?4H2O 6MgO+Al2O3+CO2↑+12H2O;90.3;
6MgO+Al2O3+CO2↑+12H2O;90.3;
(1)2NaOH+CO2=Na2CO3+H2O;(3)除去空气中的二氧化碳;除去气体中混有的水蒸气;偏大;用盐酸会使生成的二氧化碳中混有氯化氢气体;(4)60.2;小明;“药片中除了水滑石外含有一定量的辅料﹣淀粉等物质”中的淀粉受热会分解成水和二氧化碳而使结果偏大
 6MgO+Al2O3+CO2↑+12H2O;90.3;
6MgO+Al2O3+CO2↑+12H2O;90.3;(1)2NaOH+CO2=Na2CO3+H2O;(3)除去空气中的二氧化碳;除去气体中混有的水蒸气;偏大;用盐酸会使生成的二氧化碳中混有氯化氢气体;(4)60.2;小明;“药片中除了水滑石外含有一定量的辅料﹣淀粉等物质”中的淀粉受热会分解成水和二氧化碳而使结果偏大
试题分析:根据方程式的写法写出水滑石分解的方程式,根据减少的质量即为二氧化碳和水的总质量利用方程式计算出水滑石的质量,再除以10.0g即可;
(1)根据氢氧化钠与二氧化碳反应的方程式回答;
(3)根据氢氧化钠能吸收二氧化碳,浓硫酸具有吸水性考虑;根据G装置的作用考虑实验结果偏大还是偏小;根据盐酸制取气体中混有氯化氢考虑;
(4)根据前后两次质量差为0.44g属于二氧化碳的质量通过方程式计算出水滑石的质量,再除以10.0g;根据粉末中药品在通风橱中做实验时容易逸散到空气中考虑。
根据质量守恒定律可知反应前后元素种类不变,水滑石受热时生成4种不同的氧化物所以氧化物有:MgO、Al2O3、CO2、H2O再根据观察法进行配平即可,所以方程式是:[Mg6Al2(OH)16CO3]?4H2O
 6MgO+Al2O3+CO2↑+12H2O;
6MgO+Al2O3+CO2↑+12H2O;减少的质量即为二氧化碳和水的总质量,所以生成二氧化碳和水的质量为:10.0g﹣6.1g=3.9g,设生成3.9g二氧化碳和水需要水滑石的质量为X则:
[Mg6Al2(OH)16CO3]?4H2O
 6MgO+Al2O3+CO2↑+12H2O 固体质量减少量
6MgO+Al2O3+CO2↑+12H2O 固体质量减少量602 260
X 3.9g
根据:

解得X=9.03g
所以水滑石药片中水滑石的质量分数为:
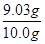 ×100%=90.3%;
×100%=90.3%;(1)氢氧化钠吸收二氧化碳的反应的反应物是氢氧化钠和二氧化碳,生成物是碳酸钠和水,用观察法配平即可,所以方程式是:2NaOH+CO2=Na2CO3+H2O;
(3)由于氢氧化钠能与二氧化碳反应生成碳酸钠和水,所以氢氧化钠的作用是除去空气中的二氧化碳;由于浓硫酸具有吸水性,所以浓硫酸的作用是吸收气体中的水蒸气;G装置的作用是防止空气中的水和二氧化碳进入F装置,若没有G装置,空气中的水和二氧化碳进入F装置,被认为是生成的二氧化碳的质量,所以计算出来的水滑石的质量偏大,则测定的水滑石的质量分数会偏大;用盐酸会使生成的二氧化碳中混有氯化氢气体,被误认为全部是二氧化碳的质量,计算出来的水滑石的质量偏大,则测定的水滑石的质量分数会偏大;
(4)由图示装置可知F装置质量的增加量是生成的二氧化碳的质量,F装置前后两次质量差为0.44g,所以生成二氧化碳的质量是0.44g,设要生成0.44g二氧化碳需要参加反应的水滑石的质量为Y则:
[Mg6Al2(OH)16CO3]?4H2O +9H2SO4=6MgSO4+Al2(SO4)3+CO2↑+21H2O
602 44
Y 0.44g
根据:

解得Y=6.02g
所以水滑石药片中水滑石的质量分数为:
 ×100%=60.2%;
×100%=60.2%;“药片中除了水滑石外含有一定量的辅料﹣淀粉等物质”中的淀粉受热会分解成水和二氧化碳而使结果偏大,所以说小明的方案合理。

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目