题目内容
100mL稀盐酸中加入混合均匀的NaHCO3和KHCO3固体粉末,充分反应后使气体全部逸出.右图是加入粉末的质量与产生CO2(该状况下,气体的密度为1.964 g/L)体积的关系.请计算:(1)该盐酸中HCl的质量.
(2)若该盐酸为120 mL时,加入粉末为58.5 g,求产生CO2的体积.
(3)若粉末的质量为x g,该盐酸的体积为140 mL,产生的CO2体积为y L.试写出粉末质量x(g)与产生CO2体积y(L)之间的关系.

【答案】分析:(1)由图示可知,生成气体的体积为11.2L,根据“质量=体积×密度”计算出生成气体的质量;然后根据HCl的相对分子质量与二氧化碳的相对分子质量和生成的二氧化碳的质量,列出比例式,即可计算出该盐酸中HCl的质量;
(2)由图示可知,完全反应时加入粉末的质量为45g,根据(1)中生成气体体积的质量即可设计出此时产生CO2的体积;
(3)根据图示盐酸体积与(3)中盐酸体积的比,得出粉末的取值范围,即可得出粉末质量x(g)与产生CO2体积y(L)之间的关系.
解答:解:(1)m(CO2)=11.2×1.964=22g;
设盐酸中HCl的质量为x.
HCl~CO2
36.5 44
x 22g
∴
解之得:x=18.25g;
(2)∵ ,
,
∴V(CO2)=11.2L×1.2=13.44L,
或者这样理解,100mL恰好与45g固体粉末反应,那么120mL只能与 =54g固体粉末反应,
=54g固体粉末反应,
故58.5g粉末过量,120mL盐酸完全反应,即V(CO2)=11.2L×1.2=13.44L.
答:(1)该盐酸中HCl的质量为18.25 g.(2)产生CO2的体积为13.44 L.
(3)m(粉末)=45×1.4=63g,(因为盐酸是原来的1.4倍)
若x≤63 g,由于是反应物的物质的量与生成的气体的物质的量,(混合物的相对分子质量根据上一问可知是90,而此时盐酸有剩余,所以按照固体物质的物质的量求算)则y= ×22.4=
×22.4= ×11.2=
×11.2= L,
L,
若x>63 g,(此时盐酸完全反应,不能继续生成气体,也可以说继续加入的物质的质量无关).则y=11.2×1.4=15.68 L,
故答案为:若x≤63 g,y= L;若x>63 g,y=15.68 L.
L;若x>63 g,y=15.68 L.
点评:本题主要考查学生运用化学方程式和已知数据进行推断的能力.
(2)由图示可知,完全反应时加入粉末的质量为45g,根据(1)中生成气体体积的质量即可设计出此时产生CO2的体积;
(3)根据图示盐酸体积与(3)中盐酸体积的比,得出粉末的取值范围,即可得出粉末质量x(g)与产生CO2体积y(L)之间的关系.
解答:解:(1)m(CO2)=11.2×1.964=22g;
设盐酸中HCl的质量为x.
HCl~CO2
36.5 44
x 22g
∴

解之得:x=18.25g;
(2)∵
 ,
,∴V(CO2)=11.2L×1.2=13.44L,
或者这样理解,100mL恰好与45g固体粉末反应,那么120mL只能与
 =54g固体粉末反应,
=54g固体粉末反应,故58.5g粉末过量,120mL盐酸完全反应,即V(CO2)=11.2L×1.2=13.44L.
答:(1)该盐酸中HCl的质量为18.25 g.(2)产生CO2的体积为13.44 L.
(3)m(粉末)=45×1.4=63g,(因为盐酸是原来的1.4倍)
若x≤63 g,由于是反应物的物质的量与生成的气体的物质的量,(混合物的相对分子质量根据上一问可知是90,而此时盐酸有剩余,所以按照固体物质的物质的量求算)则y=
 ×22.4=
×22.4= ×11.2=
×11.2= L,
L,若x>63 g,(此时盐酸完全反应,不能继续生成气体,也可以说继续加入的物质的质量无关).则y=11.2×1.4=15.68 L,
故答案为:若x≤63 g,y=
 L;若x>63 g,y=15.68 L.
L;若x>63 g,y=15.68 L.点评:本题主要考查学生运用化学方程式和已知数据进行推断的能力.

练习册系列答案
相关题目
在一定体积的10%的氢氧化钠溶液中滴加10%的盐酸,反应中溶液的温度与加入盐酸的体积变化如下:
(1)查得室温下10%氢氧化钠溶液的密度为1.02g/cm3,配制100mL这种氢氧化钠溶液,需氢氧化钠 g,其配制过程是 .
如用 mL(填“10mL”、“50mL”或“100mL”)量筒量取水时,面对刻度线,仰视读数,则所配制的溶液 10%(填“=”、“>”或“<”)
(2)试绘出溶液的温度与加入盐酸的体积之间的变化关系曲线.

(3)根据曲线讨论溶液温度变化的原因.
①加入盐酸的量在2mL~10mL之间时: .
②加入盐酸的量在10mL~20mL之间时: .
(4)若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究中和反应是否放热”,此提议是否合理?为什么?
答: .
(5)在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂,因而无法确定盐酸与氢氧化钠是否恰好完全反应.为了证明这两种物质是否恰好完全反应,从烧杯中取了少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.于是得出“两种物质已恰好完全中和”的结论.
①你认为此结论是否正确? ,理由是 ;
②写出该中和反应的化学方程式 ;
③请你另设计一个实验,探究上述烧杯中的溶液是否恰好完全中和,填写下表:
| 加入盐酸体积V/mL | 2 | 4 | 6 | 8 | 10 | 12 | 14 | 16 | 18 | 20 |
| 溶液温度上升(t)/℃ | 15.2 | 19.6 | 22.0 | 26.0 | 28.2 | 26.7 | 25.7 | 24.7 | 23.7 | 22.9 |
如用
(2)试绘出溶液的温度与加入盐酸的体积之间的变化关系曲线.

(3)根据曲线讨论溶液温度变化的原因.
①加入盐酸的量在2mL~10mL之间时:
②加入盐酸的量在10mL~20mL之间时:
(4)若某同学提出“将氢氧化钠固体直接与10%盐酸反应,以探究中和反应是否放热”,此提议是否合理?为什么?
答:
(5)在进行酸碱中和反应的实验时,向烧杯中的氢氧化钠溶液滴加稀盐酸一会儿后,发现忘记了滴加指示剂,因而无法确定盐酸与氢氧化钠是否恰好完全反应.为了证明这两种物质是否恰好完全反应,从烧杯中取了少量反应后的溶液于一支试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到酚酞试液不变色.于是得出“两种物质已恰好完全中和”的结论.
①你认为此结论是否正确?
②写出该中和反应的化学方程式
③请你另设计一个实验,探究上述烧杯中的溶液是否恰好完全中和,填写下表:
| 实验方法 | 可能观察到的现象 | 结论 |
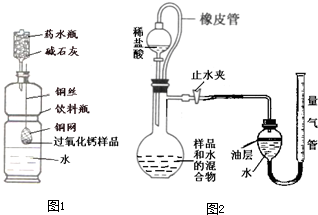 (2011?仪征市一模)长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体,为鱼提供氧气,过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一过程中进行探究:
(2011?仪征市一模)长途运输鱼苗时,人们常在水中加入少量过氧化钙(CaO2)固体,为鱼提供氧气,过氧化钙与水反应除生成氧气外,还生成什么物质?课外兴趣小组决定对这一过程中进行探究: