题目内容
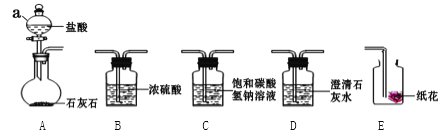
【题目】海水晒盐得到的粗盐中常含有MgCl2、CaCl2等杂质,工业提纯粗盐的过程如图所示:
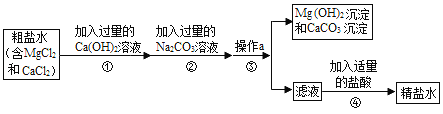
(1)步骤②反应的化学方程式为______________________________________.(任写一个)
(2)步骤④加入适量盐酸的目的是除去滤液中的Na2CO3和______.
(3)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有_______.
【答案】 MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2或Na2CO3+CaCl2=CaCO3↓+2NaCl NaOH Ca(OH)2
【解析】(1)据图分析步骤②发生的反应有:氢氧化钙溶液和氯化镁反应生成氢氧化镁沉淀和氯化钙;碳酸钠与氯化钙反应生成碳酸钙沉淀和氯化钠,反应的化学方程式为:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2或Na2CO3+CaCl2=CaCO3↓+2NaCl;(2)步骤④加入适量盐酸的目的是除去滤液中的Na2CO3和氢氧化钠;(3)若步骤①和步骤②的顺序颠倒,则最后所得的精盐水中还含有①中加入的过量的氢氧化钙未被除去与适量稀盐酸反应生成氯化钙。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】生活离不开化学,化学与生活息息相关。
(1)人体可以从水果和蔬菜中摄取________,该类物质需要量很小,但可以起到调节新陈代谢、预防疾病和维持身体健康的作用。
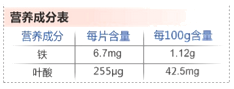
(2)如图是某儿童补铁药品的部分说明。说明中的“铁”指的是________(填“单质”、 “元素”或“分子”)。
(3)某些食品的近似pH如下:
食物 | 苹果汁 | 葡萄汁 | 牛奶 | 玉米粥 |
pH | 2.9~3.3 | 3.5~4.5 | 6.3~6.6 | 6.8~8.0 |
其中酸性最强的是__________,胃酸过多的人应食用___________。
(4)农业上用石灰乳和硫酸铜配制农药“波尔多液”时不宜用铁质容器,用化学方程式表示其原因______________________________。
【题目】某化学小组为了探究一瓶久置在空气中的氢氧化钠样品(不含有水分)的变质程度,进行了如下实验:取该氢氧化钠样品13.3 g于烧杯中,加水完全溶解,然后向烧杯中逐渐加入一定溶质质量分数的氯化钡溶液,反应过程中对加入氯化钡溶液的质量与烧杯中产生沉淀的质量进行了记录,部分数据见下表:
加入氯化钡溶液的质量/g | 20 | 40 | 80 | 100 |
生成沉淀的质量/g | 1.97 | 3.94 | 5.91 | 5.91 |
试分析计算:
(1)13.3g氢氧化钠样品中碳酸钠的质量_______;
(2)该氯化钡溶液的质量分数___________。