题目内容
【题目】实验室中有一瓶未知浓度的硫酸铜溶液,为了得知它的溶质质量分数,同学们进行了以下实验操作:向盛有100g溶质质量分数为15%的氢氧化钠溶液的烧杯中加入几滴酚酞溶液,随后向其中加入100g待测硫酸铜溶液.反应结束后,烧杯中的溶液为无色,并产生了蓝色沉淀.求:
(1)判断此时两种溶液是否完全反应,并说明理由
(2)待测硫酸铜溶液的溶质质量分数.
【答案】
(1)完全反应,若氢氧化钠有剩余,则溶液为红色;若硫酸铜有剩余,则溶液为蓝色
(2)33.3%
【解析】解:(1)氢氧化钠显碱性,能使酚酞变红色,反应结束后,烧杯中的溶液为无色,所以此时两种溶液完全反应,理由是:若氢氧化钠有剩余,则溶液为红色;若硫酸铜有剩余,则溶液为蓝色;
(2)设待测硫酸铜溶液的溶质质量分数为x,
2NaOH + CuSO4=Na2SO4+Cu(OH)2↓
80 160
100g×15% 100g×x![]() =
=![]()
x=33.3%
故答案为:(1)完全反应,若氢氧化钠有剩余,则溶液为红色;若硫酸铜有剩余,则溶液为蓝色;(2)33.3%.
(1)氢氧化钠显碱性,能使酚酞变红色;
(2)硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,然后根据氢氧化钠溶液的质量以及质量分数即可求出待测硫酸铜溶液的溶质质量分数.

 新课标快乐提优暑假作业陕西旅游出版社系列答案
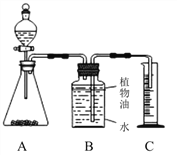
新课标快乐提优暑假作业陕西旅游出版社系列答案【题目】我国约在南北朝时就开始冶炼黄铜,黄铜是铜和锌的合金(Cu-Zn),它可用来制造电器零件及日用品。小华利用一瓶稀盐酸和相关的仪器,测定黄铜样品的组成(不考虑黄铜中的其他杂质)。将30mL稀盐酸分三次加入到10g黄铜样品粉末中,每次充分反应后,测定生成氢气的质量,实验数据见下表:
第一次 | 第二次 | 第三次 | |
连续加入盐酸的体积/mL | 10 | 10 | 10 |
生成氢气的质量/g | 0.08 | 0.08 | 0.04 |
(1)从上表数据分析,小华用10 g合金粉末总共收集到氢气g。
(2)求该合金中铜的质量分数。