题目内容
化学与生活、生产息息相关,请用所学化学知识回答.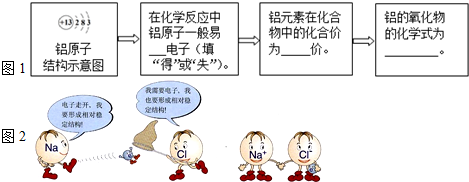
(1)H、C、O、Ca、Cl是初中常见的几种元素,请选用其中的元素写出符合下列要求的物质的化学式:
①人体胃液中含有的酸是______;②用作补钙剂的盐是______;
③产生煤炉中蓝色火焰的物质是______;④最简单的有机化合物是______.
(2)从微观的角度认识物质及其变化,更有助于了解物质组成及变化的本质.
①填写图1:
已知:氧化铝是一种两性氧化物,既可以和酸反应又可以和碱反应,生成盐和水.请你写出氧化铝和氢氧化钠溶液反应生成偏铝酸钠(NaAlO2)和水的化学方程式______.
②如图2所示为氯化钠的形成过程,由此可推知:在形成氯化镁时,镁原子和氯原子的个数比为______.

(1)H、C、O、Ca、Cl是初中常见的几种元素,请选用其中的元素写出符合下列要求的物质的化学式:
①人体胃液中含有的酸是______;②用作补钙剂的盐是______;
③产生煤炉中蓝色火焰的物质是______;④最简单的有机化合物是______.
(2)从微观的角度认识物质及其变化,更有助于了解物质组成及变化的本质.
①填写图1:
已知:氧化铝是一种两性氧化物,既可以和酸反应又可以和碱反应,生成盐和水.请你写出氧化铝和氢氧化钠溶液反应生成偏铝酸钠(NaAlO2)和水的化学方程式______.
②如图2所示为氯化钠的形成过程,由此可推知:在形成氯化镁时,镁原子和氯原子的个数比为______.
(1)①盐酸是氯化氢气体的水溶液,其中氢元素显+1价,氯元素显-1价,故化学式为:HCl;
②在碳酸钙中,钙元素显+2价,碳酸根显-2价,故化学式为:CaCO3;
③在一氧化碳中,碳元素显+2价,氧元素显-2价,故化学式为:CO;
④甲烷的化学式为:CH4;
(2)①由铝原子结构示意图可知,最外层电子数是3小于4,在发生反应时易失电子,而带正电,化合价为+3价.氧通常显-2价,所以,铝的氧化物的化学式为Al2O3;
②氧化铝和氢氧化钠溶液反应生成偏铝酸钠(NaAlO2)和水,反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O.
③在镁原子结构中,最外层有2个电子,易失去2个电子,氯原子最外层有7个电子,易得到1个电子,形成氯化镁时,镁原子和氯原子的个数比为:1:2.
故答案为:(1)①HCl;②CaCO3;③CO;④CH4;
(2)①失;+3;Al2O3;②Al2O3+2NaOH=2NaAlO2+H2O;③1:2.
②在碳酸钙中,钙元素显+2价,碳酸根显-2价,故化学式为:CaCO3;
③在一氧化碳中,碳元素显+2价,氧元素显-2价,故化学式为:CO;
④甲烷的化学式为:CH4;
(2)①由铝原子结构示意图可知,最外层电子数是3小于4,在发生反应时易失电子,而带正电,化合价为+3价.氧通常显-2价,所以,铝的氧化物的化学式为Al2O3;
②氧化铝和氢氧化钠溶液反应生成偏铝酸钠(NaAlO2)和水,反应的化学方程式为Al2O3+2NaOH=2NaAlO2+H2O.
③在镁原子结构中,最外层有2个电子,易失去2个电子,氯原子最外层有7个电子,易得到1个电子,形成氯化镁时,镁原子和氯原子的个数比为:1:2.
故答案为:(1)①HCl;②CaCO3;③CO;④CH4;
(2)①失;+3;Al2O3;②Al2O3+2NaOH=2NaAlO2+H2O;③1:2.

练习册系列答案
相关题目
