题目内容
【题目】下列各组离子能在指定溶液中大量共存的是( )
A. 在稀盐酸中:![]() 、
、![]() 、
、![]() B. 在氢氧化钠溶液中:
B. 在氢氧化钠溶液中:![]() 、
、![]() 、
、![]()
C. 在氯化钠溶液中:![]() 、
、![]() 、
、![]() D. 在硫酸铵溶液中:
D. 在硫酸铵溶液中:![]() 、
、![]() 、
、![]()
【答案】C
【解析】
A、在稀盐酸中,稀盐酸中的氢离子能与CO32-结合生成水和二氧化碳,不能大量共存,故选项错误;
B、在氢氧化钠溶液中,H+、OH-两种离子能结合成水,Zn2+、OH-两种离子能结合成氢氧化锌沉淀,不能大量共存,故选项错误;
C、K+、Ca2+、NO3-三种离子间不能结合成沉淀、气体或水,能在氯化钠溶液中大量共存,故选项正确;
D、在硫酸铵溶液中,NH4+、OH-两种离子能结合成氨气和水;铜离子和OH-两种离子能结合成氢氧化铜沉淀,不能大量共存,故选项错误。
故选:C。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
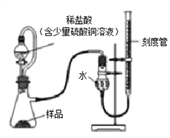
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】某白色固体可能由BaC12、NaOH、Na2CO3、Na2SO4中的一种或几种物质组成,某兴趣小组的同学为确定该白色固体的成分,进行了如下的实验探究,请你参与并回答相关问题。
I.初步探究:小金同学设计的实验过程及现象如下图所示。
(查阅资料)BaC12溶液显中性。

(初步结沦)(1)原白色固体中一定有的物质是_________,一定没有的物质是_________。
(2)M溶液中的溶质一定有__________,一定没有氯化钡。
(交流讨论)小英同学认为:无色溶液M变红色,说明溶液M中含有碱性物质,但不能由此推导出原固体物质中是否含有氢氧化钠。若要进一步确定,需对溶液M继续进行探究。为此同学们进行了如下的探究:
Ⅱ.继续探究:
(提出问题)无色溶液M中有氢氧化钠吗?
(猜想与假设)猜想一:有NaOH
猜想二:没有NaOH
(探究与结论)
实验步骤 | 实验现象 | 实验结论 |
A.取无色溶液M于试管中,加入过量的氯化钡溶液,振荡,静置 | _______________ | 证明溶液M中有碳酸钠并被除尽 |
B.取实验A所得上层清液于试管中,加入_______________。 | _____________ | 猜想一正确 |
在老师的指导下,同学们通过交流、讨论、实验,圆满地完成了这次探究活动。
【题目】某研究小组探究![]() 质量分数、溶液pH、温度对反应速率的影响,进行如下实验:
质量分数、溶液pH、温度对反应速率的影响,进行如下实验:
实验一、设计如下表实验方案:
实验序号 |
| pH | 温度 | 每分钟气泡数 |
1 | 30 | 5 | 20 | |
2 | 30 | 6 | 20 | |
3 | 30 | 11 | 20 | |
4 | 15 | 11 | 30 | |
5 | a | 11 | b |
![]() 实验
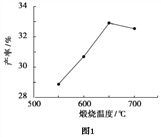
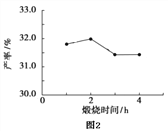
实验![]() 的实验目的是______。
的实验目的是______。
![]() 在实验5中,若
在实验5中,若![]() ,则
,则![]() ______。
______。
实验二、探究制取氧气的适宜催化剂,实验方案如下:
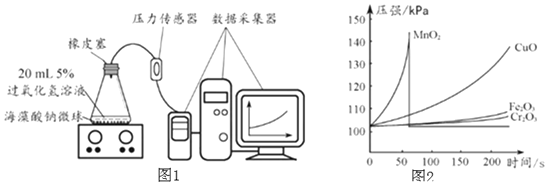
I.用![]() 、CuO、
、CuO、![]() 、
、![]() 四种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用。
四种催化剂分别与海藻酸钠溶液混合,滴入氯化钙溶液制成含等质量催化剂、大小相同的海藻酸钠微球,备用。
![]() 取30粒含
取30粒含![]() 的海藻酸钠微球,采用图1所示装置进行实验。改用其他三种微球,分别重复上述实验,得到图2的锥形瓶内压强随时间变化的曲线图。
的海藻酸钠微球,采用图1所示装置进行实验。改用其他三种微球,分别重复上述实验,得到图2的锥形瓶内压强随时间变化的曲线图。
![]() 每次实验时,海藻酸钠微球数应相同的原因______。
每次实验时,海藻酸钠微球数应相同的原因______。
![]() 从实验曲线看,催化效果较好、反应温和的催化剂是______。
从实验曲线看,催化效果较好、反应温和的催化剂是______。