题目内容
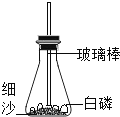
【题目】实验室制取气体所需的装置如下图所示,请回答下列问题:
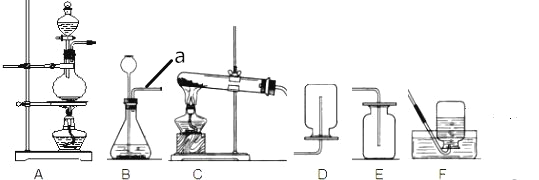
(1)仪器a的名称是_______________。
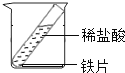
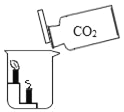
(2)选择气体收集方法时, 必须考虑的气体性质____________(填序号)①颜色 ②密度 ③溶解性 ④可燃性;收集二氧化碳所选用的装置为________(填字母)。
(3)实验室若用C装置制氧气的化学方程式为____________________________;实验室若用B装置制二氧化碳的化学方程式为________________________________。
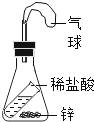
(4)氮气在很多领域用途广泛,实验室用加热NaNO2和NH4Cl的浓溶液制取氮气。
①实验室制取氮气应选择的发生装置是__________________(填序号)。
②氮气密度略小于空气,难溶于水。收集氮气时可用排水集气法,但不宜用排空气法。除排水集气法外,你还能想到的方法是:____________________。
【答案】导气管 ②③ E 2KClO3![]() 2KCl+3O2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ A 用气囊收集
2KCl+3O2↑ CaCO3+2HCl=CaCl2+H2O+CO2↑ A 用气囊收集
【解析】
(1)仪器a是导气管;故填:导气管;
(2)选择气体收集方法时,必须考虑气体的密度与溶解性;二氧化碳的密度比空气大,能溶于水,所以用向上排空气法来收集二氧化碳;故填:②③;E;
(3)装置C适用于固体加热制取气体,因为试管口没有棉花团,所以是加热氯酸钾与二氧化锰的混合物制取氧气,同时生成氯化钾;实验室中制取二氧化碳常用大理石或石灰石(主要成分是碳酸钙)和稀盐酸反应来制取,同时生成氯化钙、水,反应的化学方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑.故填:2KClO3![]() 2KCl+3O2↑;CaCO3+2HCl=CaCl2+H2O+CO2↑
2KCl+3O2↑;CaCO3+2HCl=CaCl2+H2O+CO2↑
(4)①实验室用加热NaNO2和NH4Cl的浓溶液制取氮气,属于固液加热型,所以选择装置A来制取;故填:A;
②氮气的密度略小于空气,难溶于水,收集氮气时可用排水法,但不宜用排空气法,处排水集气法外,还可用气囊收集;故填:用气囊收集。

 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案 小学教材完全解读系列答案
小学教材完全解读系列答案【题目】某课外小组用大理石与盐酸反应制取二氧化碳(大理石中杂质不与盐酸反应)。
甲同学进行实验,实验数据如下(烧杯的质量为25.0g)
烧杯+盐酸 | 大理石 | 充分反应后烧杯+剩余物 | |
甲 | 75.0g | 13.2g | 83.8g |
所取的大理石和盐酸恰好完全反应,请回答下列问题:
(1)实验中产生的二氧化碳的质量为_____。
(2)计算大理石中碳酸钙的质量分数_____(计算结果精确到01%)。