题目内容
【题目】回答下列与氧气有关的化学实验的问题:
A | B | C |
|
|
|
(1)电解水生成氧气的化学方程式为 _____________________。
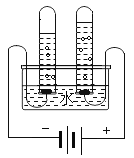
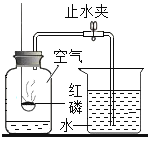
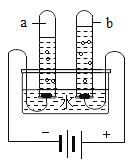
(2)实验B中,当集气瓶冷却到室温打开弹簧夹后的现象是___________________。
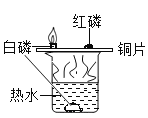
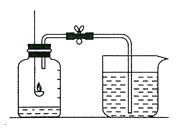
(3)实验C中,通过_____________________得出燃烧条件之一是与氧气接触。
【答案】 烧杯中的水会进入集气瓶中,约占集气瓶体积的五分之一 铜片上的白磷燃烧,水中的白磷不能燃烧
烧杯中的水会进入集气瓶中,约占集气瓶体积的五分之一 铜片上的白磷燃烧,水中的白磷不能燃烧
【解析】
电解水生成氢气和氧气,磷在氧气中燃烧生成五氧化二磷。
(1)电解水生成氢气和氧气,反应的化学方程式为 。
。
(2)氧气约占空气总体积的五分之一,磷在氧气中燃烧生成五氧化二磷,故实验B中,当集气瓶冷却到室温打开弹簧夹后的现象是烧杯中的水会进入集气瓶中,约占集气瓶体积的五分之一。
(3)实验C中,能说明燃烧需要氧气的实验现象是铜片上的白磷燃烧,水中的白磷不能燃烧,故通过铜片上的白磷燃烧,水中的白磷不能燃烧得出燃烧条件之一是与氧气接触。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案【题目】某兴趣小组的同学对实验室制备氧气的条件进行如下实验探究.
(1)小明同学知道二氧化锰能做过氧化氢分解的催化剂后,想再探究其它物质是否也可做过氧化氢分解的催化剂.请你一起参与他的探究过程,并填写下列空白:
(提出问题)氧化铜能否做过氧化氢分解的催化剂?如果能,其催化效果如何?
(设计并完成)
实验步骤 | 实验现象 |
I.分别量取 | A试管中产生气泡,带火星的木条复燃,B试管中无明显现象 |
II.持A试管中没有现象发生时,重新加入5%的过氧化氢溶液,并把带火星的木条伸入试管中,如此反复几次实验,观察现象. | 试管中均产生气泡,带火星的木条均复燃. |
III.将实验中的剩余物小心过滤,并将所得滤渣进行洗涤、干燥、称量,所得固体质量仍为 | |
IV.分别量取 |
(实验分析)
①实验II、III证明:氧化铜的________和________在反应前后均没有发生变化,________(填“能”或“不能”)作为过氧化氢分解的催化剂.
②实验设IV的目的是____________.
(2)小丽同学想探究二氧化锰的用量对过氧化氢分解速率的影响.她做了这样一组实验每次用![]() 的过氧化氢溶液,采用不同量的二氧化锰粉末做实验,测定各收集到
的过氧化氢溶液,采用不同量的二氧化锰粉末做实验,测定各收集到![]() 氧气时所用的时间,结果如下(其它实验条件均相同)
氧气时所用的时间,结果如下(其它实验条件均相同)
实验次序 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 |
二氧化锰用量(g) | 0.1 | 0.2 | 0.3 | 0.4 | 0.5 | 0.6 | 0.7 | 0.8 | 0.9 | 1.0 |
时间(秒) | 22 | 13 | 12 | 10 | 9 | 8 | 5 | 3 | 3 | 3 |
请分析表中数据,可以得出的结论是:____________.
(3)除是否使用催化剂、催化剂的种类、催化剂的质量外,还可能有哪些因素会影响过氧化氢的分解速率,你的猜想是________(任写一条即可).