题目内容
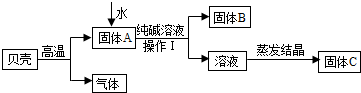
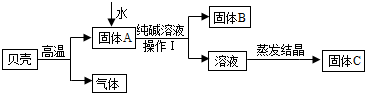
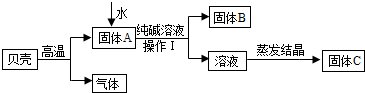
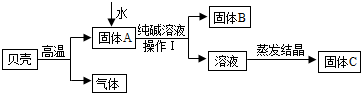
在古代,人们常用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱,某小组同学按图所示流程进行实验,请你参与讨论并回答相关问题.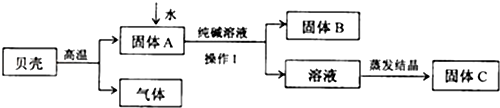
(1)贝壳高温煅烧时,发生反应的化学方程式是
(2)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是
(3)在上图中生成固体B的化学方程式是

(1)贝壳高温煅烧时,发生反应的化学方程式是
CaCO3
CaO+CO2↑
| ||
CaCO3
CaO+CO2↑
;
| ||
(2)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是
使液体受热均匀,防止液滴飞溅
使液体受热均匀,防止液滴飞溅
;(3)在上图中生成固体B的化学方程式是
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
.分析:(1)根据碳酸钙分解的反应原理书写方程式;
(2)蒸发溶液时,玻璃棒的作用是通过搅拌使液体受热均匀,防止液滴飞溅;
(3)根据氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应原理书写方程式.
(2)蒸发溶液时,玻璃棒的作用是通过搅拌使液体受热均匀,防止液滴飞溅;
(3)根据氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠反应原理书写方程式.
解答:解:(1)碳酸钙高温分解生成氧化钙和二氧化碳,方程式是:CaCO3
CaO+CO2↑;
(2)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,目的是防止液体受热不均匀,液滴飞溅;
(3)分析反应流程图可可知:碳酸钙高温煅烧生成氧化钙,氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠生成碳酸钙沉淀和氢氧化钠,方程式是Na2CO3+Ca(OH)2=Ca CO3↓+2 Na OH;
故答案为:(1)CaCO3
CaO+CO2↑;
(2)使液体受热均匀,防止液滴飞溅;
(3)Na2CO3+Ca(OH)2=Ca CO3↓+2 Na OH.
| ||
(2)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,目的是防止液体受热不均匀,液滴飞溅;
(3)分析反应流程图可可知:碳酸钙高温煅烧生成氧化钙,氧化钙和水反应生成氢氧化钙,氢氧化钙和碳酸钠生成碳酸钙沉淀和氢氧化钠,方程式是Na2CO3+Ca(OH)2=Ca CO3↓+2 Na OH;
故答案为:(1)CaCO3
| ||
(2)使液体受热均匀,防止液滴飞溅;
(3)Na2CO3+Ca(OH)2=Ca CO3↓+2 Na OH.
点评:本题是一道结合实验流程图探究烧碱制备的实验探究题,考查了学生依据物质的性质等相关知识分析、解决问题的能力;分析问题时要考虑全面,才能正确解答.

练习册系列答案
 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案
相关题目