题目内容
(2013?无锡一模)在古代,人们常用贝壳(主要成分是碳酸钙,杂质不参加反应且不溶于水)和纯碱为原料制取烧碱,某小组同学按图所示流程进行实验,请你参与讨论并回答相关问题.
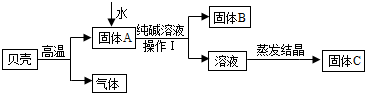
Ⅰ.定性研究
(1)生成固体B的化学反应方程式
(2)操作Ⅰ指的是
(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是
【猜想与假设】小组同学根据实验流程对所得的固体C的组成提出了质疑:甲同学认为:可能是NaOH、Na2CO3;乙同学认为:可能是
【交流与评价】请你把乙同学的可能猜想结果写在横线上;
【活动与探究】甲同学取原溶液向其中倾倒一定量的稀盐酸观察到有大量气泡产生,于是得出该溶液中的溶质是NaOH、Na2CO3的结论,证实了自己的猜想.
乙同学取原溶液向其中加入Na2CO3溶液无现象,据此否定了自己的猜想;他又重新取原溶液,向其中加入
丙同学为了验证上述结论也取原溶液向其中滴加了少量稀盐酸,却发现无气泡产生.
【解释与结论】大家经过分析找出了丙同学所用试剂与甲同学相同,却没有看到气泡的原因.你认为可能的原因是
Ⅱ.定量探究
【提出问题】固体产品C氢氧化钠的质量分数是多少呢?
【设计实验】小组同学设计了两套不同的方案进行实验并测得数据如下:
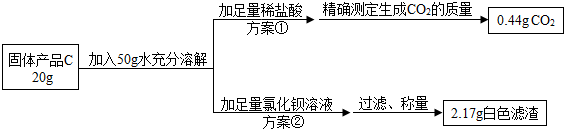
请你利用方案①所得数据计算固体产品C中氢氧化钠的质量分数(请列出计算过程)
【实验反思】
另一组同学根据方案②所得数据计算出的氢氧化钠质量分数与方案①相比明显偏小,请你分析其中的可能原因:

Ⅰ.定性研究
(1)生成固体B的化学反应方程式
Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
Ca(OH)2+Na2CO3═CaCO3↓+2NaOH
;(2)操作Ⅰ指的是
过滤
过滤
,其中要用到的玻璃仪器有烧杯、玻璃棒、漏斗
漏斗
;(3)溶液蒸发结晶得到固体C的过程中,常用玻璃棒搅拌,其目的是
搅拌,防止局部温度过高使液滴飞溅
搅拌,防止局部温度过高使液滴飞溅
.【猜想与假设】小组同学根据实验流程对所得的固体C的组成提出了质疑:甲同学认为:可能是NaOH、Na2CO3;乙同学认为:可能是
Ca(OH)2、NaOH
Ca(OH)2、NaOH
; 丙同学认为:可能是NaOH【交流与评价】请你把乙同学的可能猜想结果写在横线上;
【活动与探究】甲同学取原溶液向其中倾倒一定量的稀盐酸观察到有大量气泡产生,于是得出该溶液中的溶质是NaOH、Na2CO3的结论,证实了自己的猜想.
乙同学取原溶液向其中加入Na2CO3溶液无现象,据此否定了自己的猜想;他又重新取原溶液,向其中加入
氢氧化钙溶液
氢氧化钙溶液
观察到与甲同学不同的现象,得出了和甲同学相同的结论.丙同学为了验证上述结论也取原溶液向其中滴加了少量稀盐酸,却发现无气泡产生.
【解释与结论】大家经过分析找出了丙同学所用试剂与甲同学相同,却没有看到气泡的原因.你认为可能的原因是
少量的盐酸先与氢氧化钠反应了,所以就不能与碳酸钠反应,所以看不到有气体产生
少量的盐酸先与氢氧化钠反应了,所以就不能与碳酸钠反应,所以看不到有气体产生
.经过上述三位同学的共同努力,大家终于对溶液中溶质的成分得出了正确结论.Ⅱ.定量探究
【提出问题】固体产品C氢氧化钠的质量分数是多少呢?
【设计实验】小组同学设计了两套不同的方案进行实验并测得数据如下:

请你利用方案①所得数据计算固体产品C中氢氧化钠的质量分数(请列出计算过程)
【实验反思】
另一组同学根据方案②所得数据计算出的氢氧化钠质量分数与方案①相比明显偏小,请你分析其中的可能原因:
碳酸钡沉淀中有水分,没有干燥质量偏大,计算出来的碳酸钠质量偏大,氢氧化钠的质量就偏小了.
碳酸钡沉淀中有水分,没有干燥质量偏大,计算出来的碳酸钠质量偏大,氢氧化钠的质量就偏小了.
.分析:Ⅰ.定性研究(1)根据方程式的写法考虑;(2)根据不溶于液体的固体和液体分离的方法考虑,结合过滤操作说出需要的仪器;(3)根据蒸发时玻璃棒的作用考虑;【猜想与假设】根据判断反应后所得溶液中溶质时需要考虑反应物过量问题;【活动与探究】根据碳酸根离子与钙离子结合产生沉淀考虑;【解释与结论】少量的盐酸先与氢氧化钠反应了;【设计实验】根据二氧化碳的质量计算出碳酸钠的质量,用20g减去碳酸钠的质量就是氢氧化钠的质量,再除以20g乘以百分之百即可;【实验反思】根据碳酸钡沉淀中有水分,没有干燥计算出来的碳酸钠质量偏大,氢氧化钠的质量就偏小了;
解答:解:Ⅰ.定性研究(1)碳酸钙高温产生氧化钙和二氧化碳,氧化钙与水反应生成氢氧化钙,氢氧化钙与碳酸钠反应生成碳酸钙沉淀和氢氧化钠,用观察法配平即可,所以方程式是:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;
(2)不溶于液体的固体和液体分离的方法是过滤,过滤用到的玻璃仪器有:烧杯、玻璃棒、漏斗;
(3)蒸发时玻璃棒的作用是搅拌,防止局部温度过高使液滴飞溅;
【猜想与假设】由于碳酸钠与氢氧化钙反应生成碳酸钙和氢氧化钠,如果恰好完全反应,反应后溶液中溶质是氢氧化钠,如果碳酸钠过量,则反应后溶液中的溶质是氢氧化钠和碳酸钠,如果氢氧化钙过量,则反应后溶液中溶质是氢氧化钙和氢氧化钠;
【活动与探究】检验碳酸根离子存在方法:可以加入酸看是否有气体产生,也可以加入钙离子溶液,使其产生沉淀,所以加入氢氧化钙即可;
【解释与结论】少量的盐酸先与氢氧化钠反应了,所以就不能与碳酸钠反应,所以看不到有气体产生;
【设计实验】设生成0.44g二氧化碳需要参加反应的碳酸钠质量为X则:
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
X 0.44g
根据:
=
解得X=1.06g,C中氢氧化钠的质量分数为:
×100%=94.7%;
【实验反思】碳酸钡沉淀中有水分,没有干燥质量偏大,计算出来的碳酸钠质量偏大,氢氧化钠的质量就偏小了.
故答案为:Ⅰ.定性研究(1)Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;(2)过滤;漏斗;(3)搅拌,防止局部温度过高使液滴飞溅;【猜想与假设】Ca(OH)2、NaOH;【活动与探究】氢氧化钙溶液;
【解释与结论】少量的盐酸先与氢氧化钠反应了,所以就不能与碳酸钠反应,所以看不到有气体产生;【设计实验】94.7%;【实验反思】碳酸钡沉淀中有水分,没有干燥质量偏大,计算出来的碳酸钠质量偏大,氢氧化钠的质量就偏小了.
(2)不溶于液体的固体和液体分离的方法是过滤,过滤用到的玻璃仪器有:烧杯、玻璃棒、漏斗;
(3)蒸发时玻璃棒的作用是搅拌,防止局部温度过高使液滴飞溅;
【猜想与假设】由于碳酸钠与氢氧化钙反应生成碳酸钙和氢氧化钠,如果恰好完全反应,反应后溶液中溶质是氢氧化钠,如果碳酸钠过量,则反应后溶液中的溶质是氢氧化钠和碳酸钠,如果氢氧化钙过量,则反应后溶液中溶质是氢氧化钙和氢氧化钠;
【活动与探究】检验碳酸根离子存在方法:可以加入酸看是否有气体产生,也可以加入钙离子溶液,使其产生沉淀,所以加入氢氧化钙即可;
【解释与结论】少量的盐酸先与氢氧化钠反应了,所以就不能与碳酸钠反应,所以看不到有气体产生;
【设计实验】设生成0.44g二氧化碳需要参加反应的碳酸钠质量为X则:
Na2CO3+H2SO4═Na2SO4+H2O+CO2↑
106 44
X 0.44g
根据:
| 106 |
| 44 |
| X |
| 0.44g |
| 20g-1.06g |
| 20g |
【实验反思】碳酸钡沉淀中有水分,没有干燥质量偏大,计算出来的碳酸钠质量偏大,氢氧化钠的质量就偏小了.
故答案为:Ⅰ.定性研究(1)Ca(OH)2+Na2CO3═CaCO3↓+2NaOH;(2)过滤;漏斗;(3)搅拌,防止局部温度过高使液滴飞溅;【猜想与假设】Ca(OH)2、NaOH;【活动与探究】氢氧化钙溶液;
【解释与结论】少量的盐酸先与氢氧化钠反应了,所以就不能与碳酸钠反应,所以看不到有气体产生;【设计实验】94.7%;【实验反思】碳酸钡沉淀中有水分,没有干燥质量偏大,计算出来的碳酸钠质量偏大,氢氧化钠的质量就偏小了.
点评:解答本题关键是要熟悉方程式的书写,过滤的注意事项,蒸发时玻璃棒的作用,知道根据方程式进行的有关计算,并能根据现象分析出形成该现象的原因.

练习册系列答案
相关题目
 (2013?无锡一模)如图表示周期表中的一种元素,下列有关该元素的信息不正确的是( )
(2013?无锡一模)如图表示周期表中的一种元素,下列有关该元素的信息不正确的是( )