题目内容
12、化学兴趣小组的同学开展复分解反应研究性学习,设计了如下研究性学习思路:
【练习质疑】
下列各组物质间均能反应,写出③、④反应的化学方程式.
①氢氧化钠溶液与盐酸
②碳酸钠溶液与硫酸
③硫酸铜溶液和氢氧化钠溶液
④碳酸钠溶液和氯化钡溶液
【研究讨论】
上述反应为什么能够发生?是因为这些反应物中含有特殊的阴、阳离子,如①中有H+和OH-,②中有H+和CO32-,③中有
【构建网络】
按照一定的顺序排列这些离子,就可以形成一种网络形式.在网络中,用短线相连的这些阴、阳离子能两两结合生成沉淀或气体或水.现有Ca2+、SO42-、NH4+,请将它们填入下面合适的“( )”中,使其形成一个更为完整的复分解反应网络.
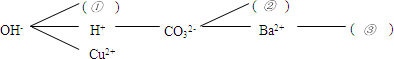
①
【拓展运用】
通过形成的网络,可以判断化合物间能否共存,进行物质的鉴别,用于物质的除杂等.如硫酸钠溶液混有硫酸铵,可以加入
【练习质疑】
下列各组物质间均能反应,写出③、④反应的化学方程式.
①氢氧化钠溶液与盐酸
②碳酸钠溶液与硫酸
③硫酸铜溶液和氢氧化钠溶液
CuSO4+2NaOH=Na2SO4+Cu(OH)2↓
.④碳酸钠溶液和氯化钡溶液
Na2CO3+BaCl2=2NaCl+BaCO3↓
.【研究讨论】
上述反应为什么能够发生?是因为这些反应物中含有特殊的阴、阳离子,如①中有H+和OH-,②中有H+和CO32-,③中有
Cu2+和OH-
,④中有Ba2+和CO32-
.【构建网络】
按照一定的顺序排列这些离子,就可以形成一种网络形式.在网络中,用短线相连的这些阴、阳离子能两两结合生成沉淀或气体或水.现有Ca2+、SO42-、NH4+,请将它们填入下面合适的“( )”中,使其形成一个更为完整的复分解反应网络.
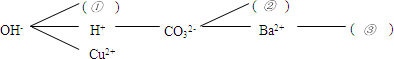
①
NH4+
,②Ca2+
,③SO42-
.【拓展运用】
通过形成的网络,可以判断化合物间能否共存,进行物质的鉴别,用于物质的除杂等.如硫酸钠溶液混有硫酸铵,可以加入
NaOH
(填写化学式)除去硫酸铵.分析:运用酸碱盐的知识解决该题,根据复分解反应的条件生成沉淀或气体或生成水复分解反应才能发生填空,最后复分解反应网络用Ca2+、SO42-、NH4+的特性解决.
解答:解:【练习质疑】硫酸铜溶液和氢氧化钠溶液反应生成氢氧化铜沉淀和硫酸钠,故③答案:CuSO4+2NaOH=Cu(OH)2↓+Na2SO4;
碳酸钠溶液和氯化钡溶液反应生成碳酸钡和氯化钠,故④答案:BaCl2+Na2CO3=BaCO3↓+2NaCl;
【研究讨论】阴、阳离子能两两结合生成沉淀或气体或水,复分解反应就可发生,③中Cu2+和OH-生成沉淀,④中Ba2+和CO32-生成沉淀,
故答案为:③Cu2+和OH-;④Ba2+和CO32-;
【构建网络】在这三种离子中NH4+与OH-能产生氨气和水,钡离子能与硫酸根离子产生白色沉淀,碳酸根离子与钙离子产生白色沉淀,
故答案:NH4+;Ca2+;SO42-;
【拓展运用】除去硫酸钠中的硫酸铵实际是除去铵根离子,有题中复分解反应网络知选用碱,又不能引入新杂质所以选氢氧化钠,
故答案:NaOH
碳酸钠溶液和氯化钡溶液反应生成碳酸钡和氯化钠,故④答案:BaCl2+Na2CO3=BaCO3↓+2NaCl;
【研究讨论】阴、阳离子能两两结合生成沉淀或气体或水,复分解反应就可发生,③中Cu2+和OH-生成沉淀,④中Ba2+和CO32-生成沉淀,
故答案为:③Cu2+和OH-;④Ba2+和CO32-;
【构建网络】在这三种离子中NH4+与OH-能产生氨气和水,钡离子能与硫酸根离子产生白色沉淀,碳酸根离子与钙离子产生白色沉淀,
故答案:NH4+;Ca2+;SO42-;
【拓展运用】除去硫酸钠中的硫酸铵实际是除去铵根离子,有题中复分解反应网络知选用碱,又不能引入新杂质所以选氢氧化钠,
故答案:NaOH
点评:本题在对复分解反应发生的条件分析的基础上对化学反应进行了考查并且延伸到物质鉴别,综合性强.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目

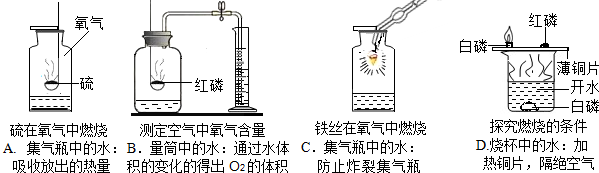
 人类的生存离不开氧气.某校化学兴趣小组的同学在老师的指导下做了有关氧气的系列探究实验:
人类的生存离不开氧气.某校化学兴趣小组的同学在老师的指导下做了有关氧气的系列探究实验:
