题目内容
实验室有三瓶失去标签的白色粉末,已知它们可能是碳酸钙、氢氧化镁、硫酸钾中的一种。请你设计实验把它们区别开来,并完成以下实验报告.
| 实验操作 | 预期现象与结论 |
| | |
| | |
实验操作 预期现象与结论 ①分别取三种白色粉末,加水溶解 能溶解的是硫酸钾,不溶解的是碳酸钙、氢氧化镁 ②再分别向不溶解的两种物质中加入稀盐酸, 有气泡冒出的是碳酸钙,能溶解但是无气泡的是氢氧化镁
解析试题分析:按照操作、现象和结论的流程来描述,①分别取三种白色粉末,加水溶解;能溶解的是硫酸钾,不溶解的是碳酸钙、氢氧化镁;②再分别向不溶解的两种物质中加入稀盐酸,有气泡冒出的是碳酸钙,能溶解但是无气泡的是氢氧化镁。故答案为:①分别取三种白色粉末,加水溶解;能溶解的是硫酸钾,不溶解的是碳酸钙、氢氧化镁;②再分别向不溶解的两种物质中加入稀盐酸,有气泡冒出的是碳酸钙,能溶解但是无气泡的是氢氧化镁。
考点:考查酸、碱、盐的鉴别

 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案小聪同学家新换了水龙头,从说明书上了解到该水龙头是铜质镀铬。好奇的小聪想探究铬(Cr)与常见金属铁、铜的活动性强弱,邀请你一同参加。
【知识回放】填写对应金属的元素符号。
金属活动性顺序:K Ca Na Mg Al Zn Sn Pb(H) Hg Ag Pt Au,请你在横线上
【作出猜想】猜想1.Cr>Fe>Cu; 猜想2. Fe>Cu >Cr; 猜想3.你的猜想是 。
【查阅资料】(1)铬是银白色有光泽的金属,在空气中其表面能生成抗腐蚀的致密的氧化膜。
(2)铬能与稀硫酸反应,生成蓝色的硫酸亚铬(CrSO4)溶液。
【设计与实验】小聪同学取大小相等的三种金属片,用砂纸打磨光亮;再取三支试管,分别放入等量的同种稀硫酸。
| 实验 | 试管1 | 试管2 | 试管3 |
| 实验 操作 |  |  |  |
| 实验 现象 | 铁片表面产生气泡较慢,溶液变为浅绿色 | 铬片表面产生气泡较快,溶液变成为蓝色 | |
【结论与解释】(1)小聪得到的结论是猜想 正确。
(2)实验前用砂纸打磨金属片的目的是 。
【知识运用】将铬片投入FeSO4溶液中,反应 (填“能”或“不能”)进行。若能进行,请你写出反应的化学方程式 。
张丽同学欲通过实验证明“二氧化锰是过氧化氢分解的催化剂”这一命题。她设计并完成了下表所示的探究实验:
| | 实验操作 | 实验现象 | 实验结论或总结 | |
| 结论 | 总结 | |||
| 实验一 | 取5mL5%的过氧化氢溶液于试管中,伸入带火星的木条 | 有气泡产生,木条不复燃 | 过氧化氢分解产生氧气,但反应速率 。 反应的化学方程式为: 。 | 二氧化锰是过氧化氢分解的催化剂 |
| 实验二 | 向盛水的试管中加入二氧化锰,伸入带火星的木条 | 没有明显现象 | | |
| 实验三 | | | 二氧化锰能加快过氧化氢的分解 | |
请你帮张丽同学填写上表中未填完的空格。
(1)在张丽的探究实验中,“实验一”和“实验二”起的作用是 。
(2)小英同学认为仅由上述实验还不能完全得出表内的“总结”,她补充设计了两个方面的探究实验,最终完成了对“命题”的实验证明。
第一方面的实验操作中包含了两次称量,其目的是: ;
第二方面的实验是利用“实验三”反应后试管内的剩余物继续实验。接下来的实验操作是: 。
学校化学兴趣小组的同学知道二氧化锰能作过氧化氢(H2O2)分解的催化剂后,想再探究其他一些物质如氧化铝是否也可作过氧化氢分解的催化剂.请你一起参与他们的探究过程,并填写下列空白.
【提出问题】Al2O3能不能作过氧化氢分解的催化剂呢?
【作出猜想】Al2O3能作过氧化氢分解的催化剂。
【实验验证】
| | 实验步骤 | 实验现象 | 实验结论 |
| 实验一 | | 有少量气泡 木条不复燃 | 常温下过氧化氢溶液分解速率很慢. |
| 实验二 | 在装有过氧化氢溶液的试管中加入少量Al2O3,然后将带火星的木条伸入试管中 | 产生大量的气泡 木条复燃 | |
【得出结论】Al2O3能加快过氧化氢的分解速率,故Al2O3能作过氧化氢分解的催化剂.
【反思提高】经过讨论,有的同学认为只有上述两个证据,不能证明Al2O3能作过氧化氢分解的催化剂,还要补充一个探究实验三:
实验三:
【实验目的】探究 。
【实验步骤】①准确称量Al2O3(少量)的质量;
②完成实验二;
③待反应结束,将实验二试管里的物质进行过滤,洗涤, ,称量;
④对比反应前后Al2O3的质量.
【交流讨论】如果Al2O3在反应前后质量不变,则说明Al2O3可以作过氧化氢分解的催化剂.
【提出新的问题】但小华认为,要证明猜想,上述三个实验还不足够,还需要再增加一个探究实验四:
实验四的目的是探究 。
某研究性学习小组将实验室制备二氧化碳气体反应后的废物进行处理,目的是制取中性干燥剂CaCl2。得到固体后,他们对固体的成分进行了如下探究:
[提出猜想]
猜想一:只有CaCl2;
猜想二:CaCl2和CaCO3;
猜想三:CaCl2和HCl。
| | 操作 | 现象 | 结论 |
| 步骤一 |  | | 猜想二成立 |
| 步骤二 |  | |
通过讨论,大家认为“猜想三”不成立,理由是 。
[实验探究]
(1)写出有关反应的化学方程式: 。
(2)实验结束后,同学们根据复分解反应发生的条件,总结出得到CaCl2的不同途径,如:
①Ca(OH)2+YCla=CaCl2+Z↓,那么Z可能是 填一种物质的化学式即可);
②CaXm+2YClb=CaCl2+H2O,则“YClb”属于 类物质。
(3)同学们又用类比的方法对CaCl2可能具有的化学性质进行了探究,总结出其能与下列物质中的 发生反应(填编号)。
①HNO3 ②AgNO3 ③Na2CO3 ④Fe(OH)3 ⑤Mg ⑥BaCO3
某化学课堂围绕“酸碱中和反应”,将学生分成若干小组,在老师引导下开展探究活动.以下是教学片段,请你参与学习并帮助填写空格(包括表中空格).
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.
【学生板演】该反应的化学方程式 .
【提出问题】实验中未观察到明显现象,部分同学产生了疑问:反应后溶液中溶质是什么呢?
【假设猜想】针对疑问,太家纷纷提出猜想.甲组同学的猜想如下:
猜想一:只有Na2SO4 猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH 猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为有一种猜想是不合理的.不合理的猜想是 .
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴CuSO4溶液,无明显变化,溶液中一定没有 .
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaC12溶液、Na2CO3溶液,进行如下三个方案的探究.
| 实验方案 | 测溶液pH | 滴加Na2CO3溶液 | 滴加BaCl2溶液 |
| 实验操作 |  |  |  |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液中有H2SO4 | 溶液中有H2SO4 | 溶液中有H2SO4 |
【得出结论】通过探究,全班同学一致确定猜想二是正确的.
【评价反思】老师对同学们能用多种方法进行探究,并且得出正确结论给予肯定.同时指出【实验探究】(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:
(1)实验操作中的错误是 .
(2)实验方案中也有一个是错误的,错误的原因是 .
某小组同学用盐酸和氢氧化钙,对酸和碱的中和反应进行探究.请你参与.
甲同学向装有氢氧化钙溶液的烧杯中加入盐酸,无明显现象.结论:两种物质未发生反应.
乙同学向滴有酚酞的氢氧化钙溶液的试管中慢慢滴加盐酸,溶液由 色变为无色.结论:两种物质发生了反应.反应的化学方程式为 .
大家认为乙的实验证明盐酸与氢氧化钙发生了中和反应.并对甲的实验继续探究.
[提出问题]甲实验后的溶液中有什么溶质?
[作出猜想]猜想一,只有CaCl2;猜想二有CaCl2和Ca(OH)2;猜想三,有CaCl2和HCl.
[实验探究]为验证猜想,丙同学设计了方案1和方案2,并按方案进行实验.
| 方案编号 | 方案1 | 方案2 | 方案3 |
| 实验操作(分别取少量甲实验后的溶液于试管中) |  | 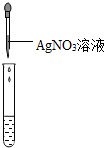 |  |
| 实验现象 | 对比标准比色卡:pH<7 | 产生白色沉淀 | |
| 实验结论 | 溶液中有HCl | 溶液中有CaCl2 |
[实验评价]丙的实验操作和方案中有不足之处,其不足之处是 .
大家讨论后通过方案3即证明了猜想三正确,其实验中应观察到的现象为 .
[实验拓展]为节约资源和避免实验废液对环境污染,小组同学将方案1和方案3及甲实验后烧杯中剩余溶液混合(混合时未见明显现象),并对混合液中的盐分离回收,请将相关内容填入下表.
| 要分离的盐 | 所用试剂 | 主要操作 |
| | | |

