题目内容
【题目】大量使用一次性塑料方便袋造成的“白色污染”,已成为一个严重的社会问题.某化学研究小组的同学欲对某种塑料袋的组成进行分析探究(资料显示该塑料只含C、H两种元素),他们设计了如图所示的实验装置,使该塑料试样在纯氧中燃烧,观察实验现象,分析有关数据,推算元素含量.
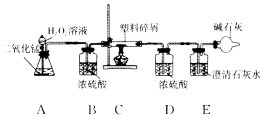
(1)仪器A中所发生反应的化学方程式为________________________________________
________________________________________________________________________.
(2)仪器B的作用是什么?
(3)仪器E中的现象是什么?
(4)若仪器C的玻璃管中放入的塑料试样质量为Wg,塑料试样充分燃烧后,若仪器D增重ag,则Wg该塑料试样中含氢元素的质量为________g(计算结果可为分数形式).
(5)若装置中没有连接仪器B,将使该塑料试样中氢元素的质量测算结果________________(填“偏小”“偏大”或“无影响”).
【答案】(1)2H2O2![]() 2H2O+O2↑
2H2O+O2↑
(2)干燥氧气(或吸收水分).
(3)澄清石灰水变浑浊.
(4)a/9
(5)偏大
【解析】浓硫酸有吸水性,因此仪器B的作用是干燥氧气(或吸收水分);因反应中会生成二氧化碳,所以澄清石灰水变浑浊;D中增加的质量是反应过程中生成水的质量,ag水中含氢元素的质量为“![]() g,根据质量守恒定律,这也是Wg该塑料试样中含氢元素的质量;若装置中没有连接仪器B,则仪器A中产生的氧气含有的水分会进入仪器D中,仪器D中增加的质量会偏大,塑料试样中氢元素的质量测算结果也必然偏大.
g,根据质量守恒定律,这也是Wg该塑料试样中含氢元素的质量;若装置中没有连接仪器B,则仪器A中产生的氧气含有的水分会进入仪器D中,仪器D中增加的质量会偏大,塑料试样中氢元素的质量测算结果也必然偏大.

练习册系列答案
相关题目