题目内容
【题目】常温下,铜制品生锈可生成绿色的铜绿。兴趣小组同学进行了下列相关探究。
探究一:甲组同学设计并进行实验,探究铜片生锈的必要条件。
【猜想】常温下,铜生锈可能与氧气、二氧化碳、水蒸气有关。
【实验】利用下图所示装置进行实验,并持续观察一个月。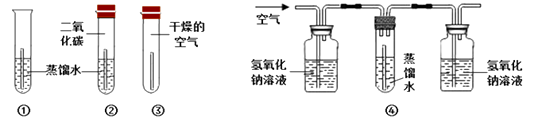
他们观察到只有实验①中铜片表面生锈,实验②、③、④中铜片始终无明显变化。
【解释与结论】
(1)试管中的蒸馏水要预先煮沸,其目的是。
(2)实验④中氢氧化钠溶液的作用是(用化学方程式表示)。
(3)得出“铜生锈一定与二氧化碳有关”的结论,依据的两个实验是(填序号)。
由上述实验推知,铜生锈的条件是与氧气、水蒸气、二氧化碳同时接触。
(4)【反思与评价】
在做猜想与假设时,同学们认为铜生锈与氮气无关,其理由是。
(5)欲进一步证明铜绿中含有碳酸盐,所需的试剂是。
(6)探究二:乙组同学探究加热铜绿会生成什么物质。
他们与老师一起进行了下图所示的实验。实验过程中,观察到试管口有无色液体产生,澄清石灰水变浑浊。实验完成后,试管内固体由绿色变为黑色。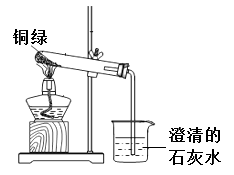
他们经过讨论,猜想黑色固体可能是氧化铜或者是炭粉,或者是二者的混合物。乙组同学继续实验,取少量黑色固体于试管中,(填实验操作以及现象),证明只有氧化铜。写出该反应的化学方程式。
【答案】
(1)除去水中溶解的氧气和二氧化碳
(2)2NaOH + CO2 = Na2CO3 + H2O
(3)①④
(4)常温下氮气的化学性质不活泼,很难和其他物质反应
(5)稀盐酸、澄清的石灰水
(6)加入足量稀硫酸(或稀盐酸),黑色固体逐渐消失,溶液变成蓝色;CuO + H2SO4 = CuSO4 + H2O(或 CuO + 2HCl= CuCl2 + H2O)
【解析】常温下,铜制品生锈可生成绿色的铜绿。探究一:甲组同学设计并进行实验,探究铜片生锈的必要条件。【猜想】常温下,铜生锈可能与氧气、二氧化碳、水蒸气有关。【实验】利用下图所示装置进行实验,并持续观察一个月。他们观察到只有实验①中铜片表面生锈,实验②、③、④中铜片始终无明显变化。【解释与结论】(1)试管中的蒸馏水要预先煮沸,其目的是除去水中溶解的氧气和二氧化碳。
(2)实验④中氢氧化钠溶液的作用是2NaOH + CO2 = Na2CO3 + H2O。
(3)得出“铜生锈一定与二氧化碳有关”的结论,依据的两个实验是①④。【反思与评价】
(4)在做猜想与假设时,同学们认为铜生锈与氮气无关,其理由是. 常温下氮气的化学性质不活泼,很难和其他物质反应。
(5)欲进一步证明铜绿中含有碳酸盐,所需的试剂是稀盐酸、澄清的石灰水。探究二:乙组同学探究加热铜绿会生成什么物质。下图所示的实验。实验过程中,观察到试管口有无色液体产生,澄清石灰水变浑浊。实验完成后,试管内固体由绿色变为黑色。
(6)经过讨论,猜想黑色固体可能是氧化铜或者是炭粉,或者是二者的混合物。乙组同学继续实验,取少量黑色固体于试管中,加入足量稀硫酸(或稀盐酸),黑色固体逐渐消失,溶液变成蓝色。证明只有氧化铜。该反应的化学方程式是CuO + H2SO4 = CuSO4 + H2O(或 CuO + 2HCl= CuCl2 + H2O)。
故答案为:(1)除去水中溶解的氧气和二氧化碳;(2)2NaOH + CO2 = Na2CO3 + H2O;(3)①④;(4)常温下氮气的化学性质不活泼,很难和其他物质反应;(5)稀盐酸、澄清的石灰水;(6)加入足量稀硫酸(或稀盐酸),黑色固体逐渐消失,溶液变成蓝色;CuO + H2SO4 = CuSO4 + H2O(或 CuO + 2HCl= CuCl2 + H2O)
(1)气体的溶解度随温度的升高而减小;
(2)本题考查碱化学性质和气体的除杂方法;
(3)利用控制变量法可以分析出铜生锈的条件;
(4)考查氮气的化学性质;
(5)利用碳酸根的检验方法即可解答;
(6)利用氧化铜和碳化学性质的差异即可解答.