题目内容
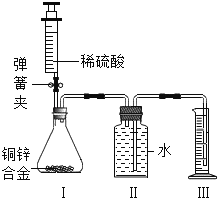
【题目】现有一瓶混有少量氯化钾的硝酸钾粉末,请参照右图KCl和KNO3溶解度曲线,回答下列问题:
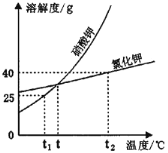
(1)t℃时,KCl和KNO3两种物质饱和溶液的溶质质量分数_______。
(2)t2℃时20g KCl溶于______g水中恰好形成饱和溶液。
(3)t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的是____的溶液。
(4)在提纯混有少量氯化钾的硝酸钾时,先在较高温度下将混合物溶于水中形成热的浓溶液,然后____,即有大量硝酸钾晶体析出,再进行____,即可分离得到较为纯净的硝酸钾晶体。
【答案】相等 50 KNO3 降温结晶 过滤
【解析】
(1)t℃时,KCl和KNO3两种物质的溶解度相等,故饱和溶液的溶质质量分数相等,故填:相等。
(2)t2℃时,氯化钾的溶解度为40g,故20g KCl溶于50g水中恰好形成饱和溶液,故填:50。
(3)硝酸钾的溶解度随温度的升高变化明显,故t2℃时,两物质的等质量饱和溶液降温至t1℃,析出固体质量较大的硝酸钾,故填:硝酸钾;
(4)在提纯混有少量氯化钾的硝酸钾时,需要采用降温结晶的方法,先在较高温度下将混合物溶于水中形成热的浓溶液,然后降低温度,即有大量硝酸钾晶体析出,再进行过滤操作,即可分离得到较为纯净的硝酸钾晶体,故填:降温结晶;过滤。

【题目】在一次聚餐中,同学们对燃料“固体酒精”产生了兴趣,于是对该固体酒精的成分进行探究。
(查阅资料)(1)固体酒精由酒精、氯化钙和氢氧化钠按一定质量比例混制成。
(2)氯化钙溶液呈中性,碳酸钠溶液呈碱性。
(提出问题)(1)酒精中是否含有碳元素?
(2)该固体酒精中的氢氧化钠是否变质?
(实验探究)(1)按如图实验,发现澄清石灰水变浑浊,可得出酒精中含有碳元素的结论,此结论_____(填“合理”或“不合理”)
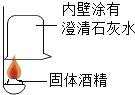
(2)取少量该固体酒精于烧杯中,加足量的水充分溶解后静置,发现烧杯底部有白色沉淀,取沉淀于试管中加稀盐酸,有气泡产生,该气体是_____。
(实验结论)分析实验并结合资料得出氢氧化钠已变质。
(拓展实验)为进一步确定氢氧化钠的变质程度,小北同学做了以下实验:
实验方案 | 实验现象 | 实验结论 |
取烧杯中上层清液于试管中,加入几滴酚酞溶液 | 溶液变红 | 清液中有氢氧化钠 |
另取烧杯中上层清液于试管中,加入澄清石灰水溶液 | 产生_____ | 清液中有碳酸钠 |
(1)有同学认为小北的实验不能证明清液中一定有氢氧化钠,理由是_____。
(2)该同学另取烧杯中上层清液,加入足量的氯化钙溶液充分反应,有白色沉淀生成,反应后滴加酚酞溶液,溶液变红,加入足量氯化钙溶液的目的是_____,写出生成沉淀的化学方程式:_____。
(3)实验结论:固体酒精中氢氧化钠的变质程度是_____(填“完全变质”或者“部分变质”)
【题目】物质的溶解性受到各种因素的影响,请根据下列信息回答问题:
表一:常温下,一些物质在水中的溶解度
Ba(NO3)2 | BaCl2 | AgCl | AgNO3 | |
水 | 9.2g | 33.3g | 0.00015g | 170.0g |
表二:常温下,一些物质在乙醇中的溶解度
Ba(NO3)2 | BaCl2 | NaOH | NaCl | Ca(NO3)2 | CaCl2 | |
乙醇 | 0.002g | 4.1g | 14.7g | 0.07g | 33.9g | 20.5g |
(1)表一、表二数据说明物质的溶解性受到_____等因素的影响。
(2)常温下,40g水中加入2gBa(NO3)2固体,充分溶解,得到溶液质量为_____g。
(3)酸、碱、盐在溶液中发生复分解反应的条件是有沉淀析出、或有气体放出、或有水生成。请回答
①表一中物质在水中发生复分解反应的化学方程式_____。
②表二中物质在乙醇中发生复分解反应的化学方程式_____。从微观的角度看,溶液中减少的微粒是_____(写微粒符号)。